
血小板(platelet)是由骨髓巨核细胞产生并释放于血液循环中的最小细胞,在止血和凝血过程中发挥着重要的作用。 由于血小板保质期较短,临床输注需求量大, 加之临床输注需求时间的不确定性, 造成了血小板过期浪费和临床供不应求的两难尴尬局面。 目前国内血小板主要保存方式是22℃振荡保存,有效期为 5d。 此外血小板还可深低温冰冻保存, 但这种方法的保存效果和临床疗效不确切。 冷冻干燥技术已广泛应用于各种生物材料的保存, 冻干制品具有常温下保存、 性能稳定、便于运输的特点。 本研究以过期血小板为原料,探索血小板冻干再水化的条件,检测其冻干再水化后凝血功能的变化, 为过期血小板再利用及新鲜血小板冰冻或低温保存研究提供了依据。
1、 材料与方法
1.1 实验材料
1.1.1 血小板来源 实验组选择体检合格, 一周内未服用阿司匹林等抗血小板药物的自愿献血者,用血细胞分离机单采富含血小板血浆,22℃振荡保存 5d 过期;对照组选择新鲜机采血小板。
1.1.2 主要试剂和溶液 海藻糖 (CH22O11·2H2O,北京经科宏达生物技术有限公司); 牛血清白蛋白(BSA,上海生工生物工程有限公司);磷酸盐缓冲液(PBS); 血小板聚集诱导剂二磷酸腺苷(ADP,Sigma公司);凝血酶(Sigma 公司);胶原(Sigma 公司);瑞斯托霉素(Sigma 公司);CD62P-PE(Bioscience 公司);PAC-1-FITC(BDIS 公司 ); 海藻糖加载缓冲液 ( 含50mmol/L 海藻糖,100mmol/L NaCl,10mmol/L KCl,10mmol/L EGTA,pH 为 6.8);冻干保护剂(含 20%海藻糖 ,1% 牛血清白蛋白 ,9.5mmol/L HEPES,142.5mmol/L NaCl,4.8mmol/L KCl,1mmol/L Mg-Cl2);复水溶液为 PBS 缓冲液和蒸馏水以 3:1 比例混合制成。 以上试剂和溶液均在有效期内。
1.2 主要仪器 冷冻干燥机(LabConco,美国);恒温振荡水浴(Bellco Glass,美国);流式细胞仪(FACS-Calibur,BD,美国);血球计数仪(CELL-DYN 1700,Abbott,美国);血小板聚集仪(APACT-2 型)。
1.3 实验方法
1.3.1 血小板的冻干保存 血小板浓缩液离心洗涤后重悬于海藻糖加载缓冲液中, 将上述悬浮液转移进入离心管中,并用聚四氟乙稀生料带密封,于37℃水浴中振荡孵化 4h。 将孵化后的血小板悬浮液 800g 离心 3min。 去除上层孵化液,得到沉淀的血小板块,加入冻干保护液打散重悬,使用血球计数仪进行计数, 调节血小板在冻干保护液中的浓度为 1×109个/ml。 将制备好的血小板冻干悬浮液装入特制冻干血盒中,密封充注口。 将血小板冻干悬液先以 20℃/min 的速率冻结至-40℃, 预冻 2h后,再以 1.5℃/min 对搁板升温至-30℃,退火 0.5h,然后进入一次干燥,-38℃维持一次干燥条件 20h,最后以 0.2℃/min 的加热速率使隔板温度升高至20℃,维持二次干燥条件 10h 直至冻干结束。 冻干的血小板密封保存在室温。
1.3.2 冻干血小板的水化 将 PBS 缓冲液和蒸馏水以 3:1 的比例混合制成血小板冻干复水液,将1ml 复水液在室温下直接加入冻干样品瓶中,轻轻震荡直到样品完全溶解于复水溶液中。
1.3.3 检测血小板回收率 用血球计数仪分别对冻干前和冻干再水化后的血小板计数, 计算冻干再水化血小板回收率。冻干再水化血小板回收率(%)=冻干再水化后血小板计数/冻干前血小板计数×100%。
1.3.4 检测血小板稳定性 冻干再水化血小板分别在室温放置 0h、2h、4h、6h、8h 后,用血球计数仪测定血小板回收率。
1.3.5 血小板形态及超微结构观察 用扫描电镜观察血小板的形态;分别以戊二醛固定、脱水、环氧树脂包埋后制作超薄切片, 用透射电镜观察血小板超微结构变化。
1.3.6 血小板聚集反应检测 将冻干血小板复水后转入离心管中进行洗涤以去除细胞外保护剂,再用新鲜冰冻血浆重悬血小板, 调整血小板浓度为(0.2~0.3)×1012/L。 用 APACT-2 型血小板聚集仪检测冻干再水化后血小板对四种同浓度诱导剂—凝血酶、胶原、ADP 和瑞斯托霉素的聚集反应。
1.3.7 血小板表面糖蛋白检测 用三色流式细胞仪分别检测冻干再水化血小板表面激活指标 CD62p和 PAC-1 的表达,经凝血酶激活后测定 CD62p 和PAC-1 的再表达。 再表达率=凝血酶处理后表达率-血小板表达率1.3.8 统计分析 数据以均数±标准差(x±s)表示,采用 SPSS16.0 统计软件进行数据分析处理, 组间差异比较用 t 检验,P<0.05 为差异有统计学意义。
2、 结果
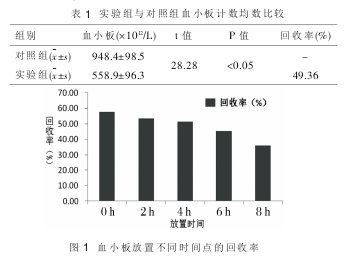
2.1 血小板回收率及稳定性 实验组和对照组间血小板计数有统计学意义(P<0.05),冻干再水化血小板回收率为 49.36%,见表 1;冻干再水化血小板稳定性随血小板放置时间的延长, 血小板回收率逐渐下降,见图 1。
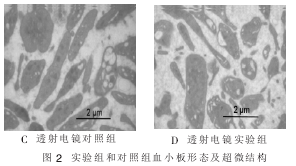
2.2 血小板形态及超微结构 扫描电镜显示新鲜血小板透光性较强,形态呈圆形或椭圆形,边缘光滑, 而冻干再水化血小板透光性较弱, 血小板变形,见图 2A 和 B。 透射电镜显示新鲜血小板着色较深,α 颗粒、致密颗粒、过氧化酶颗粒等分散、清晰,而冻干再水化血小板着色较浅,致密颗粒及 α颗粒不够清晰,且数目少于对照组,见图 2C 和 D。
2.3 聚集反应 实验组和对照组间血小板同浓度诱导剂下的最大聚集率均有统计学意义 (P<0.05),实验组血小板对凝血酶、胶原、ADP 和瑞斯托霉素的聚集功能较对照组均出现下降,见表 2。

2.4 血小板表面糖蛋白 实验组 CD62p 表达率和再表达率分别为 50.25%、94.27%,均显著高于对照组的 8.12%、78.43%(P<0.05);凝血酶作用后 CD62p再表达率为 44.02%,显著低于对照组 70.31% (P<0.05)。 实验组 PAC-1 表达率为 3.85%,与对照组相比较无显著性差异 (P>0.05),PAC-1 再表达率为42.75%,显著低于对照组 67.29%(P<0.05),凝血酶作用后 PAC-1 再表达率为 38.90%,显著低于对照组 65.28%(P<0.05),见表 3。
3、讨论
血小板数目减少或功能不全所致出血性疾患的预防和治疗,临床多采用输注血小板制剂。 血小板保存技术的缺陷是血小板过期浪费和临床供不应求的两难处境的主要原因,因此,研究出一种能长期、高效、安全和方便的血小板保存方法一直是国内外输血工作者关注的热点和难题。

将过期的血小板再利用及血小板的冻干保存有着广阔的应用前景。 本研究显示冻干再水化的过期血小板回收率及稳定性较差, 说明冻干和再水化过程对血小板功能造成一定影响, 应进一步改进冻干保存时搁板温度,复水液组分和比例,以及增加预复水步骤。 透射电镜下新鲜血小板着色相对较深, 可能为新鲜血小板生物活性较高或膜通透性相对较高,因而有较强吸附染料的能力。
CD62p 和 PAC-1 分别为血小板表面活化晚期标志物和活化早期的标志物, 结果显示过期血小板对凝血酶、ADP、 胶原及瑞斯托霉素的最大聚集率明显小于新鲜血小板,凝血酶作用后 CD62p 和 PAC-1 的再表达率低于新鲜血小板,说明过期以及冻干和再水化过程对血小板凝血功能有影响, 但冻干再水化的过期血小板仍具有一定的存活能力和功能活性, 因此选择血小板进行冷冻干燥保存是血小板长期保存切实可行的方法, 为新鲜血小板冷冻干燥保存提供理论依据。 但对该方法保存血小板的回收率、 稳定性以及凝血功能等还需做进一步研究与改进,以达到临床应用的要求。
参考文献:
[1]王捷熙,杨超,王艳,等.小分子糖负载血小板+冻干保护剂混合悬液的相变点测定与屏蔽实验研究[J].中国输血杂志,2010,5(23):338-340.
[2]王捷熙,韩颖,杨超,等.生物化学稳定法冰冻干燥血小板制剂的功能研究[J].中国输血杂志,2010,5(23):341-343.
[3]池春燕,林力红.外科 DIC 患者输注冷沉淀凝血因子的疗效观察[J].实验与检验医学,2014,32(1):53-56.
[4]邓日富.临床用血情况分析[J].实验与检验医学,2013,31(4):388-389.
[5]徐祥莲,王丽,徐晶,杨娟,等.2008 年至 2011 年南昌市地区捐献机采血小板情况分析[J].实验与检验医学,2012,30(6):615-616.
[6]周俊,张长虹,刘景汉,等.冻干血小板功能的体外评价[J].中国输血杂志,2008,10(21):774-777.





