
MicroRNA(miRNA)是广泛存在于真核生物中的一类具有调控功能的非编码 RNA,通过互补或不完全互补的方式识别并结合靶基因引导沉默复合体,使靶基因 mRNA 降解或调控其蛋白翻译,从而在转录后水平影响基因和(或)蛋白的表达。近年来研究证实,miRNA 的调节紊乱与一些肿瘤的发生密切相关,并且许多 miRNAs 调控位点位于与细胞癌变密切相关的细胞周期调控因子基因、癌基因或抑癌基因上,这对于癌症病因学的研究具有重要意义。
我们将 Ambion 公司开发的人类成熟的miRNA库分别转染到常用的胃癌 AGS 细胞,通过 Alamarblue 测定 AGS 细胞的增殖,筛选并确定对 AGS 细胞增殖有显著抑制作用的 miRNA。经过大规模的筛选后发现 miRNA-491-5p 明显抑制 AGS 细胞增殖。研究报道 miRNA-491-5p 可通过影响间质金属蛋白酶 9 的表达在多形性胶质母细胞瘤发挥作用。另外,miRNA-491-5p 对口腔鳞状细胞癌的细胞侵袭有作用。MiRNA-491-5p 在胃癌细胞中具体的作用机制还不明了。为了继续进行其功能研究,本研究拟构建miRNA -491 -5p的慢病毒过表达载体, 转染HEK293T 细胞,应用实时荧光定量 PCR 检测转染细胞中 miRNA-491-5p 的表达量,以判断慢病毒载体过表达 miRNA-491-5p 的程度。接着将其包装成病毒颗粒,进一步感染胃癌 AGS 细胞,筛选 miRNA-491-5p 稳定表达细胞株。
1、材料与方法
1.1 材料
AGS 细胞、HEK293T 细胞、胃癌细胞的基因组、E. coli Top10 (由本实验室保存),1640 培养基、胎牛血清(Gibco 公司),慢病毒表达质粒 PCDH-511B ( SBI 公 司 ) ,ViraPowerTMLentiviral PackagingMix、M-MLV 逆转录酶 ( Invitrogen 公司 ) ,限制性内切酶BamH Ⅰ、EcoR Ⅰ和 DNA Marker(Fermentas公司),DNA 片段快速回收 Kit、质粒抽提试剂盒(Axygen 公司),胰蛋白酶(Sigma 公司),FastStart Uni-versal SYBR Green (ROX)(Roche 公司),Prime STAR高保真 DNA 聚合酶、T4 DNA 连接酶(TAKARA公司)。
1.2 方法
1.2.1 PCDH-511B-miRNA-491-5p 载体构建 在UCSC中查询获得人的 miR-NA-491-5p 基因序列,用 Primer 6.0 设计获得上游引物 5’-CCGgaattcTTTCTGGGTAGCCTTTAGC-3’和下 游 引 物 5’-CGCggatccTCAAATAGCCATCCTA-CACT-3’。如小写字母所示,寡核苷酸序列两端分别加上 EcoR Ⅰ和 BamH Ⅰ酶切位点。PCR 反应体系及参数为:10×PCR buffer 2.5 μL、2.5 mmol/L dNTP2.0 μL、25 mmol/L MgCl21.0 μL、10 μmol/L 上游引物 0.5 μL、10 μmol/L 下游引物 0.5 μL、胃癌细胞的基因组 0.3 μL、Prime STAR 高保真 DNA 聚合酶0.3 μL、补足 ddH2O 至 25 μL;PCR 条件为 95 ℃预变性 5 min,94 ℃ 20 s,58 ℃ 30 s,72 ℃ 30 s;35 个循环;72 ℃延伸 10 min。将 PCDH-511B 载体与 PCR产物进行双酶切,纯化后连接。然后转化 E.coliTop10,涂布卡纳抗性的 LB 平板,37 ℃过夜培养。重组质粒经过双酶切鉴定,PCR 扩增鉴定后送交南京金斯瑞生物有限公司进行测序。
1.2.2 实时荧光定量 PCR 检测 PCDH -511B -miRNA-491-5p 载体过表达 miRNA-491-5p 的程度 将重组质粒 PCDH-511B-miRNA-491-5p 与 PCDH-511B 空质粒通过 LipofectamineTM2000(Invitrogen 公司)分别转染到 HEK293T 细胞,48 h 后吸掉旧培养基,接着用常规 Trizol 试剂(Invitrogen 公司)抽提总RNA,DEPC 水溶解沉淀,核酸蛋白分析仪(Beckman Coul-ter,USA)测定 RNA 浓度,根据 RNA 在 A260/A280≥1.8及甲醛变性凝胶电泳 28 S、18 S RNA 条带比值≥1.5鉴定 RNA 纯度及完整性。取总 RNA 1 μg 加入无菌蒸馏水 12 μL,混匀后 72 ℃孵育 5 min,随即置于冰上;在另一去 RNase 的 PCR 管中配置以下反应液:dNTP mixture 2.0 μL、Rnase 抑制剂 0.5 μL、miR-NA-491-5p 逆转录引物0.5 μL、RNU6B 逆转录引物0.5 μL、5 ×buffer 4.0 μL、M -MLV 逆转录酶 0.5 μL(Invitrogen 公司);与总 RNA 的溶液混匀,42 ℃孵育60 min,所得 cDNA 置于-20 ℃保存。构建 miRNA-491 -5p 和 RNU6B 的 Real time -PCR 反应体系:cDNA 5.0 μL、Primers 1.0 μL、SYBR Green Ⅰ荧光染料 10 μL、无菌蒸馏水 8.0 μL;反应条件:95 ℃预变性 10 min;95 ℃ 15 s、65 ℃ 30 s、72 ℃ 30 s,共 40 个循环;循环结束后72 ℃延伸 10 min,每个标本均作复管 PCR 反应,至少重复 3 次(PCR 仪采用 ABI 7500)。
采用 RNU6B 作为内参照,用 RNU6B 的拷贝数作为校正基数,通过 LightCycle 软件直接获得各样本中 miRNA-491-5p 的 Ct(cycle threshold)值,与同样本中 RNU6B 的 Ct 值相减,即获得该样本中 miR-NA-491-5p 的 ΔCt 值;由于以 Real time-PCR 来检测 RNA 时,受到不同 RNA 样本存在不同的逆转录(RT)效率的限制,用正常 HEK293T 细胞的 ΔCt 值作为校正抽提 RNA 进行定量 PCR 检测,得出-ΔΔCt值,按目的基因表达量=2-ΔΔCt公式计算各样本中miRNA-491-5p 的相对表达量。
1.2.3 包装 PCDH-511B-miRNA-491-5p 病毒颗粒HEK293T 细胞常规培养于 10 cm 细胞培养皿,并采用含 100 mL/L 胎牛血清的 1640 培养液,置于 37 ℃的 CO2培养箱中培养。2~3 d 换 1 次培养液。PCDH-511B-miRNA-491-5p 重组质粒载体和空载体质粒与病毒包装系统(ViraPowerTMLentiviral PackagingMix)共同转染 293T 细胞,第 4 或第 5 天收集上清液,离心(5 000 r/min 5 min,RT),0.45 μm 的滤器过滤。收获的病毒液 26 000 r/min,2 h 4 ℃离心后弃去上清浓缩,再用适量不含血清的培养基或 PBS、1%BSA 重悬病毒,-80 ℃储存备用。
1.2.4 筛选 miRNA-491-5p 的稳定表达细胞株 接种 2×105AGS 细胞到 6 孔板,使其过夜后能融合至30%~50%;加入不同梯度的病毒—1640 混合物,设6 个梯度,按×10-1、×10-2、×10-3、×10-4、×10-5、×10-6进行系列稀释;37 ℃、5%的 CO2培养箱中培养过夜;第3 天更换新鲜的 1 640 培养基;感染后 3~4 d,荧光显微镜下观察各孔中绿色荧光蛋白(green fluorescentprotien,GFP)的荧光表达情况。每毫升病毒原液含有具感染能力的病毒颗粒的个数=GFP 阳性细胞个数×稀释倍数。接着将感染过的细胞传代,并在 24 孔板内以(5~8)×104cells/孔的密度铺板,孵育过夜后,吸除旧的培养基,然后加入含有适量浓度(由杀灭曲线确定)的puromycin(嘌呤霉素)的新鲜培养基,每 2~3 d替换新鲜配制的筛选培养基;每天检测细胞并观察活细胞生长比例,以及 GFP 表达的水平及所占比例。大约 2 周后筛选出稳定的细胞株。
2、结果
2.1 PCR 扩增人 miRNA-491-5p 基因 以 AGS 胃癌细胞基因组为模板,克隆 miRNA-491-5p 基因,产物大小约为 460 bp,这与理论估计相一致(图 1)。

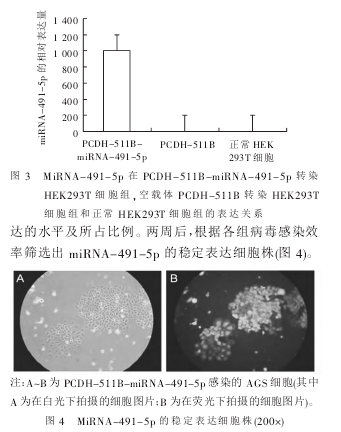
PCDH-511B-miRNA-491-5p 重组质粒的构建见图2。对 PCR 产物和 PCDH-511B-miRNA-491-5p 载体进行双酶切、凝胶回收后按 T4 连接酶说明书上的体系连接。转化后挑取酶切鉴定为阳性的单克隆送交南京金斯瑞生物科技有限公司测序,确保目的片段正确性。测序结果证实所得到的片段与 miRNA-491-5p 基因序列相一致,可以用于后续研究。2.2 实时荧光定量 PCR 检测 PCDH-511B-miRNA-491-5p 载体过表达 miRNA-491-5p 的 程 度 定量PCR 进行均一化处理,结果显示非转染 HEK293T 细胞组为 1,空载体 PCDH-511B 转染 HEK293T 细胞组相对于非转染 HEK293T 细胞组无显著变化(1.19±0 . 14 ) ,而 PCDH - 511B - miRNA - 491 - 5p 转 染HEK293T 细胞组为(1 000.18±1.14),差异具有统计学意义(P<0.01)。根据 2-ΔΔCt方法算出 miRNA-491-5p表达变化的倍比关系,结果表明 PCDH-511B-miR-NA-491-5p 转染 HEK293T 细胞组的 miRNA-491-5p 表达明显高于其他两组,见图 3。这表明:PCDH-511B-miRNA-491-5p 慢病毒过表达载体构建成功,可用于后续实验。
2.3 PCDH-511B-miRNA-491-5p 病毒颗粒包装PCDH-511B-miRNA-491-5p 重组质粒载体和空载体质粒与病毒包装系统共同转染 HEK293T 细胞,HEK293T 细胞部分融合,出现多核复合体;随着病毒增殖,细胞逐渐从壁上脱落,出现细胞病变效应。
2.4 筛选 miRNA-491-5p 的稳定表达细胞株 PCDH-511B-miRNA-491-5p 慢病毒过表达载体及空载体PCDH-511B 病毒颗粒感染 AGS 细胞后 72 h 观察到细胞荧光。进一步将感染过的细胞传代,按实验要求每天检测细胞并观察活细胞生长比例,以及 GFP 表达的水平及所占比例。两周后,根据各组病毒感染效率筛选出 miRNA-491-5p 的稳定表达细胞株(图 4)。
3、讨论
MicroRNA 是一类在各种生物体内广泛存在的非编码的、单链的、不编码蛋白质的小分子 RNA,长度为 20~24 个碱基。1993 年,在研究线虫的过程中人们发现了第 1 个 microRNA 分子,自此之后,人们陆续在不同物种中发现了多种 microRNA 分子。
目前,在 miRBase 数据库(第 19 版)中已包含 100 多个物种,共计 21 264 条 microRNA 序列。在人类中,目前已经发现了 1 600 种前体 microRNA(precursormicroRNA,pre-miRNA)和 2 042 种成熟的 microRNA。
编码人 microRNA 的基因占到基因组的 1%左右,调控约 1/3 的基因。MicroRNA 可以通过两种方式起到其生物学作用:第 1 种方式为 microRNA 与靶mRNA 完全结合,从而使其断裂降解;第 2 种方式为microRNA 与靶 mRNA 部分配对,此时其与 mRNA的 3’UTR 部分结合从而抑制其翻译,影响蛋白质表达的效率,但是并不影响 mRNA 的稳定性。通过与靶 mRNA 的结合,microRNA 参与多种调控过程,与人类的多种系统的疾病密切相关。MicroRNA 在肿瘤的发生过程中也起着十分重要的作用,可参与大多数肿瘤相关基因的表达过程。
慢病毒载体是指以人类免疫缺陷病毒-1 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
本研究构建了 miRNA-491-5p 过表达载体,转染HEK293T细胞后发现PCDH-511B-miRNA-491-5p慢病毒过表达载体在 HEK293T 细胞中成功表达,表明 PCDH-511B-miRNA-491-5p 慢病毒过表达载体构建成功,可用于后续实验。接着将其包装成病毒颗粒,该病毒可以高效感染 AGS 细胞,通过加入含有适量浓度(由杀灭曲线确定)的 puromycin(嘌呤霉素),通过筛选获得 miRNA-491-5p 稳定表达细胞株。为进一步分析 miRNA-491-5p 对胃癌细胞的作用机制奠定基础。





