
表达 CD5 抗原的 B 细胞即 B1a 细胞广泛分布于小鼠胸腔和腹腔,也存在于脾脏中,约占其 B 细胞总量的 5%.这种细胞能够产生多种多反应性及亲和力低的自身抗体,并且能够分泌具有免疫抑制作用的IL-10[1].TLR7受体是一种模式识别受体,能够识别病原相关模式分子从而引发先天性免疫反应并起始获得性免疫反应[2].已知 TLR7 激动剂能够使 Naive B 细胞增殖及活化,且促进其产生趋化因子、造血生长因子以及其他细胞因子如 IL-6 和IL-10[3,4].重要的是,小鼠 B 细胞分泌的 IL-10 主要来自于 CD5+B 细胞[5-7].虽然激活 TLR7 能促进小鼠 B 细胞分泌 IL-10,但 TLR7 激动剂是否影响 B细胞表达 CD5 迄今尚无报道.为此,本文用 B220+磁珠从小鼠脾脏细胞中分选出 B 细胞,在体外用TLR7 激动剂处理,观察 TLR7 激动剂对分泌 IL-10的 CD5+B 细胞的比例变化,并分析 TLR7 激动剂对于 B 细胞表达 CD5 的比例及其 MFI 的变化,以探讨TLR7 通路活化对小鼠脾脏 B 细胞表达 CD5 的影响.
1 材料与方法
1. 1 材料
1. 1. 1 实验动物 SPF 级 C57 /B6 小鼠,购于南京大学模式动物研究所.
1. 1. 2 主要试剂与仪器 PE-anti-CD5、IL-10-APC、小鼠 B220+阳性选择磁珠及其分离产品购自 Milte-nyi 公司; R848( TLR7 激动剂) 购自 Sigma 公司; 抑制剂 PDTC( NF-κB 抑制剂) 、SP600125( JNK 抑制剂) 、SB203580( p38 抑制剂) 以及 PD98059( ERK 抑制剂) 均购自碧云天公司; RPMI1640 与胎牛血清由Gibco 公司购得; 流式细胞仪为 BD FACS calibur 公司仪器.
1. 2 方法
1. 2. 1 B 细胞的分离纯化 脱颈处死 B6 小鼠,放入 75%酒精 10 min,在超净台内取出小鼠脾脏置于无菌磷酸盐缓冲液( PBS) 内,用 5 ml 一次性无菌注射器吸取无菌 PBS 反复吹打脾脏; 然后用滤网过滤,除去组织团块.4℃,1 200 r/min 离心 5 min,去上清,按照 107脾脏细胞加入 1 ml 磁珠专用分离Buffer 重悬,然后加入 100 μl B220+磁珠,用移液枪混匀,4℃孵育 15 min,孵育过程中每 5 min 轻微震荡混匀一次; 加入5 ml PBS 洗一次,4℃,1 200 r/min离心 5 min,去上清; 然后将沉淀混匀于 1 ml 磁珠分离 Buffer 中用 LS 磁珠分离柱进行阳选,即得到纯化的小鼠脾脏 B 细胞.
1. 2. 2 细胞培养 将 B 细胞以为 5 × 105每孔的量接种于 96 孔培养板中,设置 3 个重复孔,于 37℃、5% CO2培养箱中培养.
1. 2. 3 添加抑制剂及激动剂 将分离纯化的 B 细胞于 37℃、5%CO2培养箱中培养 30 min,然后在各个相应孔中加入以下浓度的 TLR7 通路抑制剂:
SP600125( JNK 抑制剂) 10 μmol / L、PDTC( NF-κB 抑制剂) 10 μmol/L、SB203580( P38 抑制剂) 10 μmol/L及 PD98059( ERK 抑制剂) 10 μmol/L 混匀后放置于培养箱培养 30 min 后分别每孔再加入1 μmol/LR848 后混匀培养.不需要加入抑制剂的实验操作,直接在铺板后 1 h 向每孔加入 1 μmol/L R848 后混匀培养.
1. 2. 4 流式细胞术检测 B 细胞表面 CD5 及其内部IL-10 CD5 的检测: 将各孔细胞转移到流式管中,用 PBS 洗一遍细胞,4℃,1 200 r/min 离心 5 min,去除上清,加入 1 μl CD5-PE,于旋涡振荡仪上混匀,4℃ 孵育 30 min,加入 200 μl PBS 重悬,上流式细胞仪进行检测.
胞内 IL-10 的检测: 1 200 r/min 离心 5 min,去除上清,直接加入 1 ml fixation 重悬细胞,室温固定20 min,加入 2 ml PBS 洗涤一次,加入 1 ml perme-abilization 重悬细胞,4℃ 避光孵育 30 min,1 200 r /min 离心 5 min 去除上清,往每管各加入 1 μl IL-10-APC,震荡混匀后于 4℃ 避光孵育 30 min,加入 1 mlpermeabilization 洗涤 2 次,最后加入 200 μl PBS,上机检测.
1. 3 统计学分析 所有实验数据均以 x-± s 来表示,用 Prism 5. 0 对实验数据进行分析,两组间数据采用 t 检验分析.P <0. 05 为差异具有显著性.
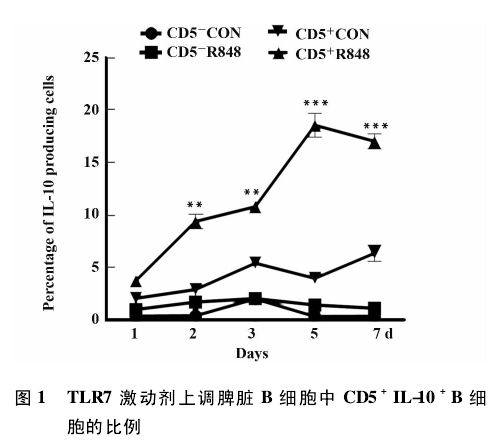
2 结果
2. 1 TLR7 激动剂上调小鼠脾脏 B 细胞中 CD5+IL-10+B 细胞的比例 IL-10 在小鼠 B 细胞中主要是由 CD5+B 细胞分泌,为了确定 TLR7 激动剂能否上调 CD5+IL-10+B 细胞 的比例,我们在第 1 天用R848 刺激 B 细胞,并用流式细胞术连续检测了 1 ~7 d B 细胞表达 CD5 和 IL-10 的动态变化.结果显示,与对照组相比,R848 能够以时间依赖性的方式持续性地上调 CD5+IL-10+B 细胞 的比例 ( P <0. 01) ,而 CD5-IL-10+B 细胞的比例无变化( 图 1) .
2. 2 TLR7 激动剂上调 B 细胞表达 CD5 在正常状态下小鼠脾脏 B 细胞中 CD5+B 细胞的比例约为5% ,为了进一步验证 TLR7 激动剂是否能够促进 B细胞表达 CD5,我们用 R848 刺激 B 细胞并用流式细胞仪连续检测了 1 ~7 d CD5+B 细胞比例和 CD5MFI 的变化.结果显示,与对照组相比,R848 能够以时间依赖性的方式显著上调 B 细胞表达 CD5( 图2A) ,并且 在第 7 天 CD5 的上调比例达到峰值27. 78% ( P < 0. 001) .另外从第 1 天至第 4 天,CD5的 MFI 也呈现出显著的持续上调( 图 2B) .
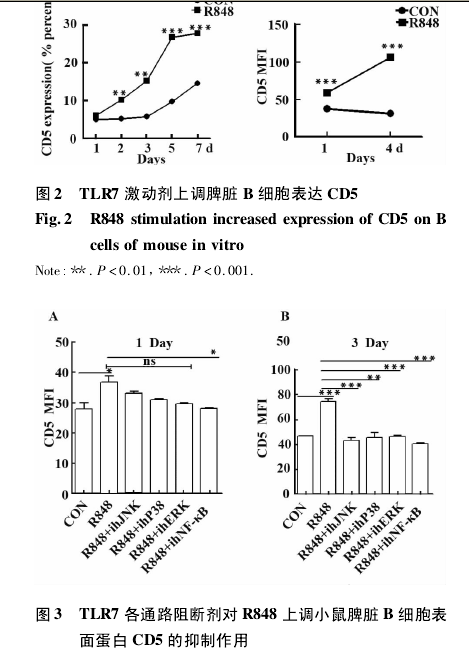
2. 3 TLR7 下游通路均与 B 细胞表达 CD5 有关TLR7 下游有 JNK、P38、ERK 及 NF-κB 四条信号通路,为了进一步验证 TLR7 主要通过哪条信号通路实现其对 CD5 表达的调控,我们预先用四条通路的阻断剂分别处理 B 细胞1 h 后加入 R848 刺激剂,并用流式检测 CD5 表达的抑制情况.结果显示,R848显著促进了 B 细胞上调表达 CD5,NF-κB 阻断剂在第 1 天就显示出其对 B 细胞表达 CD5 的显著性抑制( P <0. 05) ( 图 3A) ,而四条通路阻断剂在第 3 天均显示出对 CD5 表达的显著性抑制( P <0. 05) ( 图3B) .这些结果说明 TLR7 下游通路均可促进 B 细胞上调表达 CD5.
3 讨论
小鼠 B 细胞分泌的 IL-10 主要来自于 CD5+B细胞[5-7].既然 TLR7 刺激能够诱导 B 细胞产生 IL-10,那么 TLR7 通路的活化对于 B 细胞表达 CD5 是否有影响呢? 首先,我们研究发现 TLR7 激动剂能够上调分泌 IL-10 的 CD5 阳性 B 细胞的比率,这与已报道的研究结果一致.一些研究指出 CD5+B 细胞自身比 CD5-B 细胞存活时间要长,且 B 细胞分泌的 IL-10 能够维持人和小鼠 CD5+B 细胞的长期存活[8-10],这与我们发现在体外培养 7 d 后对照组CD5+B 细胞的比例也有所升高的现象是一致的.
2009 年,Garaud 等[11]通过转染 CD5 基因于不表达 CD5 基因的 B 细胞系,发现这种 B 细胞分泌IL-10 的能力与 CD5 的表达成正相关; 随后 Garaud等[12]发现表达 CD5 的 B 细胞中转录因子 NFAT2 和STAT3 的入核直接与 IL-10 在 B 细胞中的表达水平有关,即使在 CD5-B 细 胞 中转染了 NFAT2 和STAT3 基因也不能让该细胞表达 IL-10,说明 CD5通过控制转录因子 NFAT2 和 STAT3 的入核来控制IL-10 的表达.我们发现 TLR7 刺激能够促进 IL-10的表达,提示 TLR7 通路有可能通过促进 CD5 的表达间接促进 B 细胞分泌 IL-10.
关于 CD5+B 细胞的来源一直存在争议,目前有两种假说: 一种假说叫种系假说,该假说认为 B1a细胞来源于胚胎或者出生后早期的前体细胞,而 B2细胞来源于不同的前体细胞.另一种假说则认为,CD5+B 和 CD5-B 细胞来源于同一种细胞前体,CD5+细胞是经过某些特殊的抗原刺激后发生了基因重排所形成的[13].早在 1991 年 Cong 等[14]在体外验证: anti-IgM 能够诱导常规 B 细表达 CD5.我们的研究发现 TLR7 通路的活化能够促进脾脏 B 细胞上调 CD5 蛋白的表达,提示 TLR7 通路活化可能通过某些通路诱导常规 B 细胞表达 CD5.至于这种现象究竟是 TLR7 激动剂通过诱导常规 B 细胞表达 CD5,还是激动剂对本来存在的 CD5+B 细胞作用所致有待通过分选 CD5 阳性和阴性的 B 细胞进行验证.不管 CD5+B 细胞的来源到底属于哪种 假说,CD5+B 细胞本身具有很强的自我更新能力,虽然目前其自我更新机制尚未明了,但是在正常生理状态下 CD5+B 细胞的数量受到了严格的控制,在新生小鼠脾脏内 CD5+B 细胞 的比例为 30% ~40% ,2 周后其比例约为 5% 左右[15].最新研究指出 B1 细胞表面存在大量的小鼠唾液酸结合性免疫球蛋白样凝集素 G( Siglec-G) ,这种凝集素可能对控制 CD5+B 细胞的数量至关重要[16,17].还有研究表明 CD5+B 细胞数量或者功能的异常出现在多种自身免疫性疾病如类风湿性关节炎、系统性特发性血小板减少性紫癜( ITP) 以及慢性 B 淋巴细胞白血病中[18].
综上所述,TLR7 激动剂能够显著上调 CD5+IL-10+B 细胞的比例; 并且能够促进脾脏 B 细胞高表达 B 细胞表面分子 CD5; 进一步,TLR7 下游 NF-κB、P38、ERK 及 JNK 通路的活化均能促进 B 细胞表达CD5.这些结果说明 TLR7 刺激直接影响小鼠 B 细胞中 CD5 的表达,进而影响其 IL-10 的分泌等功能.
提示 TLR7 改变 CD5+IL-10+B 细胞的比例可能参与自身免疫性疾病进程.
参考文献:
[1] Berland R,Wortis HH. Origins and functions of B-1 cells withnotes on the role of CD5 [J]. Annu Rev Immunol,2002,20:253-300.
[2] Gururajan M,Jacob J,Pulendran B. Toll-like receptor expressionand responsiveness of distinct murine splenic and mucosal B-cellsubsets [J]. PLoS One,2007,2( 9) : e863.
[3] Agrawal S,Gupta S. TLR1/2,TLR7,and TLR9 signals directlyactivate human peripheral blood naive and memory B cell subsetsto produce cytokines,chemokines,and hematopoietic growth fac-tors [J]. J Clin Immunol,2011,31( 1) : 89-98.
[4] Genestier L,Taillardet M,Mondiere P,et al. TLR agonists selec-tively promote terminal plasma cell differentiation of B cell subsetsspecialized in thymus-independent responses [J]. J Immunol,2007,178( 12) : 7779-7786.
[5] O'Garra A,Chang R,Go N,et al. Ly-1 B ( B-1) cells are themain source of B cell-derived interleukin 10 [J]. Eur J Immunol,1992,22( 3) : 711-717.
[6] Barr T A,Brown S,Ryan G,et al. TLR-mediated stimulation ofAPC: Distinct cytokine responses of B cells and dendritic cells[J]. Eur J Immunol,2007,37( 11) : 3040-3053.
[7] Sindhava V,Woodman ME,Stevenson B,et al. Interleukin-10mediated autoregulation of murine B-1 B-cells and its role in Bor-relia hermsii infection [J]. PLoS One,2010,5( 7) : e11445.
[8] Hayakawa K,Hardy RR. Development and function of B-1 cells[J]. Curr Opin Immunol,2000,12( 3) : 346-353.
[9] Pers JO,Jamin C,Youinou P,et al. Role of IL-10 in the distri-bution of B cell subsets in the mouse B-1 cell population [J]. EurCytokine Netw,2003,14( 3) : 178-185.
[10] Gary-Gouy H,Harriague J,Bismuth G,et al. Human CD5 pro-motes B-cell survival through stimulation of autocrine IL-10 pro-duction [J]. Blood,2002,100( 13) : 4537-4543.
[11] Garaud S,Le Dantec C,de Mendoza AR,et al. IL-10 produc-tion by B cells expressing CD5 with the alternative exon 1B [J].Ann N Y Acad Sci,2009,1173: 280-285.
[12] Garaud S,Morva A,Lemoine S,et al. CD5 promotes IL-10 pro-duction in chronic lymphocytic leukemia B cells through STAT3and NFAT2 activation [J]. J Immunol, 2011,186 ( 8 ) :4835-4844.
[13] Wortis HH,Berland R. Cutting edge commentary: origins of B-1cells [J]. J Immunol,2001; 166: 2163-2166.
[14] Cong YZ,Rabin E,Wortis HH. Treatment of murine CD5-B cellswith anti-Ig,but not LPS,induces surface CD5: two B-cell acti-vation pathways [J]. Int Immunol,1991,3( 5) : 467-476.
[15] Sun CM,Deriaud E,Leclerc C,et al. Upon TLR9 signaling,CD5+B cells control the IL-12-dependent Th1-priming capacityof neonatal DCs [J]. Immunity,2005,22( 4) : 467-477.
[16] Hoffmann A,Kerr S,Jellusova J,et al. Siglec-G is a B1 cell-in-hibitory receptor that controls expansion and calcium signaling ofthe B1 cell population [J]. Nat Immunol, 2007,8 ( 7 ) :695-704.
[17] Ding C,Liu Y,Wang Y,et al. Siglecg limits the size of B1a Bcell lineage by down-regulating NFkappaB activation [J]. PLoSOne,2007,2( 10) : e997





