巨噬细胞( Macrophages,MΦ) 是机体抗感染免疫的主要效应细胞,在脊椎动物中 MΦ 来源于两类造血细胞.一是来源于胚胎期的卵黄囊和胎肝,并进一步发育成组织定居 MΦ;二是来源于骨髓中的单核细胞前体,经血液进入结缔组织或器官后进一步分化成组织定居 MΦ 或炎性 MΦ.MΦ 主要的生理功能是发挥吞噬功能,但在感染或组织受损时可激发炎症反应和进一步的免疫应答,参与组织稳态的维持.因而,深入研究 MΦ 发育和功能的调控,对于进一步阐明稳态维持和免疫应答的发生机制,以及多种疾病的临床治疗都具有重要的意义.本文拟从 MΦ 的类型,激活方式和 Notch 调控 MΦ激活的分子机制三个方面进行综述.
1 、MΦ 类型
MΦ 是在表型和功能上高度异质的细胞亚群.基于其解剖位置和功能表型可分为静息状态下执行吞噬功能的组织定居 MΦ( tissue-resident macrophage) 和炎症刺激下参与免疫应答 的 骨 髓 单 核 细 胞 来 源 的 炎 性 MΦ ( inflammatorymacrophage) .组织定居 MΦ 可来自哺乳动物胚胎期原始造血.Schulz 等[1]的研究表明,来自胚胎期卵黄囊的 MΦ 受转录因子 PU. 1 的调控; 而在成年个体,位于骨髓的造血干细胞( hematopoietic stem cells, HSC) 经 过 共 同 髓 样 祖 细 胞( common myeloid progenitor,CMP) 、粒细胞/单核细胞祖细胞( granulocyte-monocyte progenitor,GMP) 和 MΦ/DC 祖 细 胞( macrophage-dendritic cell progenitor,MDP) 等阶段,产生单核细胞( monocyte) 进入外周血.进入血液的单核细胞在几天内可通过循环进入各种组织并分化为组织定居 MΦ 如 Kupffer细胞、小胶质细胞、肺泡 MΦ、破骨细胞等[2].然而,就组织定居 MΦ 的来源问题,Hashimoto 等[3]和 Yona 等[4]的研究均显示,在成体静息状态下,组织定居 MΦ 主要来自局部的自我更新和维持,而较少地来自循环的单核细胞.炎性 MΦ 主要来自单核前体细胞,是当组织发生炎症、坏死等损伤时,骨髓来源的单核前体细胞在趋化因子的作用下进入损伤部位而形成[5].然而 Jenkins 等[6]对炎性 MΦ 的来源提出了挑战,他们认为在丝状线虫( Litomosoides Sigmodonitis) 诱导的 IL-4驱动下的 Th2 型炎症反应中,炎性 MΦ 的聚集,不是来自于血液中具有潜在组织破坏能力的单核细胞,而是由组织定居MΦ 经历了快速的原位增殖而产生.目前关于炎性 MΦ 的来源问题已成为热点争议问题.
2 、MΦ 激活方式.
炎性 MΦ 的产生,是 MΦ 激活的表现形式,也是机体抵抗病原体入侵和重构组织稳态的一种免疫应答方式.在组织微环境中,MΦ 的激活受到多种因素的影响,包括病原体的入侵、体内坏死细胞、细胞碎片以及一系列细胞因子等的刺激,从而导致 MΦ 在吞噬能力、细胞因子及趋化因子的分泌能力、抗肿瘤抗病原体能力、对趋化因子做出应答以及对抗原的加工递呈能力等方面发生明显变化,这种过程即为 MΦ的激活.
不同的微环境使存在其中的 MΦ 产生不同形式的激活,经过激活的 MΦ 可以行使特定的功能.MΦ 主要有以下两种激活方式: 经典激活的 MΦ( classically activated macrophage,M1) 和替代激活的 MΦ ( alternatively activated macrophage,M2) .M1 型 MΦ 是由 Th1 细胞和 NK 细胞等免疫细胞产生的抗 炎 因 子 γ-干 扰 素 ( interferon-γ, IFN-γ ) 和 脂 多 糖( lipopolysaccharide,LPS) 、肿瘤坏死因子-α ( tumor necrosisfactor-alpha,TNF-α) 、粒细胞-MΦ 集落刺激因子( granulocyte-macrophage colony stimulating factor,GM-CSF) 等诱导 MΦ 形成的,在不同的组织中以不同的形态存在,但都具有以下共同特点: 可分泌大量促炎性细胞因子,如白介素家族分子IL-1β,IL-15,IL-18,IL-12 和 IL-6 以及 TNF-α; 可分泌趋化因子配体( chemokine 1igand,CL) ,如 CC 型的 CCL15,CCL20 和CX 型的 CXCL13; 可分泌具有抑制血管生成作用的趋化因子配体,如 CXCL10 和 CXCL11.这些炎性介质的释放,促进了机体有效清除异己成分.在功能上,M1 型 MΦ 具有很强的内吞作用,自身抗原呈递能力上升,可通过多种机制对侵入细胞内的病原体进行杀伤,比如限制微生物可利用的铁元素等营养物质,酸化吞噬小体,合成活性氧中间体( reactive oxygenintermediates,ROI) ,以及通过表达诱导型一氧化氮合酶( inducible nitric oxide synthase,iNOS) 来释放 NO.M2 型细胞则是由 IL-4 和 IL-13 诱导 MΦ 形成的[7].此外,转化生长因子-β( transforming growth factor-β,TGF-β) 家族的一些成员、本丙酸诺龙 A 和 IL-21 最近也被证实可以诱导 M2 型 MΦ 激活[8 -9].有趣的是,趋化因子受体 CCR4 也在 MΦ 向 M2 极化中起重要作用,提示 CCR4 在促进 MΦ 迁移的同时诱导其发生 M2 极化[10].值得注意的是,M2 型 MΦ 激活不是单一形式的 MΦ 激活,如 IL-4 和 IL-13 诱导了 M2a 型 MΦ 的激活、免疫复合物( poly: I-C) 诱导了 M2b 型 MΦ 的激活以及 IL-10和糖皮质激素诱导了 M2c 型 MΦ 激活[11] .
因此,鉴于 MΦ 不同的激活形式,Mosser 等[12]提出按功能将活化的 MΦ 划分为 3 个基本亚群,一是经典活化的 MΦ,与 M1 型 MΦ 相对应; 二是创伤愈合 MΦ,与 M2a 型 MΦ 相对应,可以产生胶原,促进创伤愈合和组织修复; 三是调节性MΦ,不能够产生胶原,包括 M2b 型和 M2c 型 MΦ,以及多种其他刺激活化的 MΦ.
3、 Notch 信号调控 MΦ 激活的分子机制.
3. 1 Notch 信号 Notch 受体在进化中结构保守,在细胞间的信号传递和决定细胞命运方面有着重要意义.在哺乳动物体内,已发现的 Notch 受体有4 类: Notch1、Notch2、Notch3 和Notch4.Notch 受体是一种 I 型单次跨膜蛋白,结构上分为胞外区、跨膜区和胞内区.Notch1 和 2 型受体的胞外区含有约36 个表皮生长因子样重复序列,一个二聚体结构域以及 3 个Lin /Notch 重复序列 ( Lin / Notch repeats,LNR ) 结构域,而Notch3 型和 4 型的胞外区表皮生长因子样重复序列稍短一些,分别为 34 和 29 个; 胞内区由 RBP-Jκ 相关分子结构域( RBP-Jκ-associated molecule region,RAM) ,CDC10/ankyrin 重复序列,转录激活结构域以及1 个由脯氨酸、谷氨酸、丝氨酸和苏氨酸形成的 PEST 结构域组成( Notch4 有所不同,缺失一段转录激活结构域)[13].Notch 受体可通过胞外区与相邻细胞上同样是 I 型跨膜蛋白的配体相互作用,对细胞的分化产生影响.Notch 的配体有 Delta( Delta1、Delta 3、Delta 4) 和Jagged ( Jagged1 和 Jagged2) .通过配体和受体的相互作用,Notch 受体的胞内结构域被 γ-分泌酶水解为 2 段,释放出Notch 胞内段( Notch intracellular domain,NICD) .因为 NICD上有一段核定位信号,可介导 NICD 进入核内.之后,通过RAM 结构域,NICD 与转录因子 CSL[CBF / Su( H) / LAG-1( 在哺乳动物中为 CBF1/RBP-J; 在果蝇中为 Su( H) ; 在昆虫中为LAG-1) ]作用,激活原本处于抑制状态的靶基因.以哺乳动物为例,在 NICD 缺失的情况下,RBP-J 蛋白募集了起到抑制作用的组蛋白去乙酰化酶( histone deacetylase,HDAC) 和共抑制复合物( corepressor,CoR) ,并结合在靶基因的调控区,抑制靶基因的表达; 在 NCID 存在的情况下,RBP-J 蛋白与HDAC 和 CoR 解离,与 NICD 相结合并募集对靶基因表达有激活作用的复合物,如智者样基因 1 ( mastermind-like-1,MAML1) 和 组 蛋 白 乙 酰 转 移 酶 ( histone acetyltransferase,HAT) ,从而促进下游靶分子的表达.靶分子包括: 生毛蛋白断裂增强子 1( hairy enhancer of split 1,HES1) 、HEY1( hairy/enhancer-of-Split related with YRPW motif 1) 、白介素 2 受体 α 链( interleukin 2 receptor α,IL2Rα) 、白介素 7 受体( interleukin 7receptor,IL-7R) 、ATF 样的碱性亮氨酸拉链转录因子 ( ATF-like basic leucine zipper transcription factor,BATF) 和髓细胞组织增生致癌基因( myelocytomatosis oncogene,MYC)[14].但在这些靶分子中除了 HES1 和 HEY1 主要是通过 Notch 信号通路所调节的外,IL2RA、IL7R、BATF 和 MYC 也可被其他信号通路所激活[15] .尽管 RBP-J 在 Notch 信号通路中发挥重要作用,但是,Martinez 等[16] 的研究表明,Notch 信号通路也可独立于 RBP-J 发挥作用,而且 RBP-J 也可被其他替代的信号途径所激活.
3. 2 Notch 信号与 MΦ Notch 信号通路具有调控造血干细胞的自我更新、分化以及决定其后代细胞命运的功能.四种Notch 受体在造血细胞上都有表达.研究表明,Notch1 在胸腺细胞、MΦ 以及骨髓中的前体细胞中有表达; Notch2 在胸腺细胞、B 淋巴细胞以及前体细胞中表达; Notch3 在许多不同种类的造血细胞中都有表达; Notch4 主要存在于内皮细胞,同时在 MΦ 和单核细胞中也有表达,但在 MΦ 中表达水平较低.另外,在未成熟的造血细胞中,Notch1 和 2 的表达水平很低; 而在髓样细胞系中,两种受体的表达水平很高[17]; 在免疫细胞上不仅可表达 Notch 受体,Yamaguchi 等[18]的研究表明,在 MΦ、单核细胞以及脾脏来源 DC 细胞上还可以检测到 Notch 配体如 Delta1 或者 Jagged1,同时腹膜腔和脾脏的MΦ 所表达的 Notch 配体也有很大的差异.此外,Nomaguchi等[19]的研究表明,受到 MΦ 集落刺激因子( macrophage colonystimulating factor, M-CSF) 、 粒 细 胞-MΦ 集 落 刺 激 因 子( granulocyte-macrophage colony stimulating factor,GM-CSF) 以及IL-3作用的 MΦ 倾向于高表达 Jagged1.而这种激活作用可能与 NF-κB 的激活作用有关.这一研究为在不同类型的 MΦ中,Notch 配体的表达有所不同提供了有力的支持.
3. 3 Notch 信号调控 MΦ 激活的分子机制 目前的研究提示,Notch 信号途径可调控体内多种免疫细胞发育和功能,如在 T/B 淋巴细胞的发育方向上的选择等,但对 MΦ 发育和功能的调控作用尚无明确定论.Schroeder 等[20]发现,Notch 通路活化可以上调转录因子PU. 1 的表达,从而促进 MΦ 等多种髓系细胞的分化.PU. 1是调控髓系发育的关键转录因子,在髓系祖细胞向粒细胞和单核细胞分化方向选择以及单核细胞向 MΦ 和树突细胞分化方向选择中都发挥重要作用.而且 PU. 1 和肌腱膜纤维肉瘤癌基因家族 B 蛋白( musculoaponeurotic fibrosarcoma oncogenefamily protein B,MafB) 之间的平衡对于单核细胞分化的方向也具有重要意义.研究表明,适度表达 PU. 1 可诱导单核细胞向 MΦ 方向分化[21] .此外,Notch 信号通路对调控破骨细胞的发育也有重要意义.破骨细胞是贮留在骨组织的 MΦ,小鼠骨髓剔除 Notch1-3 后,破骨细胞生成增多,通过 Jagged1活化 Notch 通路后,小鼠骨髓细胞向破骨细胞分化减少,说明Notch 信号途径通过抑制破骨细胞的发育从而抑制骨质的溶解[22].上述的研究结果都表明 Notch 信号通路可能调控 MΦ的发育.
Notch 信号也参与 MΦ 免疫功能的调控.有研究发现,在小鼠 MΦ 系 Raw264. 7 细胞中过表达 Notch1 受体可增强 IFN-γ 诱导的 STAT1 依赖的转录,上调 IFN-γ 调控因子,抑制细胞间黏附分子 1( intercellular adhesion molecule 1,ICAM1) 和主要组织相容性复合体Ⅱ( major histocompatibility complexclass Ⅱ,MHC-Ⅱ) 分子的表达,继而调控与抗原递呈和杀伤相关基因的表达[23].除了 Notch 受体,不同的 Notch 配体也对 MΦ 功能具有调控作用,Fung 等[24]
发现在 LPS 通过 TLR诱导人 MΦ 活化过程中,Notch 配体 Dll-4 表达显著增高,但Notch 受体没有受到影响,应用 Dll-4 活化人 MΦ 的 Notch 信号通路可以上调 iNOS 等促炎基因的表达.此外,研究表明配体 Dll-4 可显著活化 MΦ 中 Notch 信号和 NF-κB 通路表达[25].
Hu 等[15]研究表明,在 MΦ 功能的调控中,Notch 通路与TLR 通路之间存在协同作用,而 Notch 信号通路在其中发挥的最终效应取决于通过 RBP-J 的直接作用和通过 HES1、HEY1 的负反馈作用两者之间的力量平衡.IRF 家族的成员对于 MΦ 极化具有转录调节作用.在对于 Toll 样受体( Toll-like receptors,TLR) 通路刺激的应答中,干扰素调节因子 8( interferon regulatory factor 8,IRF8) 由 IFN-γ 诱导产生,并可诱导产生多种细胞因子,包括 IFN-β、IL-12p40、IL-12p35 以及 iNOS.Xu 等[26]研究发现,Notch-RBP-J 信号通路和 TLR信号通路可通过 IRF8 蛋白协调作用,进而诱导 MΦ 向 M1 方向极化.IRF8 是 Notch-RBP-J 信号通路的下游分子,RBP-J可通过激活 MNK1 激酶而选择性地调节 TLR4 信号通路,进而诱导 M1 型细胞相关基因的表达,包括 IL-12p40、IL-12β 和NOS2.
我们研究组近期的研究发现,Notch 信号途径在实体瘤中可以决定 MΦ 的 M1/M2 激活模式,而且 Notch 信号对 MΦ激活 模 式 的 调 控 可 能 是 通 过 细 胞 因 子 信 号 抑 制 物 3( suppressor of cytokine signaling,SOCS3) 实现的.这与 Liu等[27] 关于 SOCS3 的表达对于 M1 型 MΦ 的激活具有重要意义的研究相一致.同时 Palaga 等[28]也发现,用 GSI 处理 MΦ,阻断Notch 信号通路,会使 M1 型 MΦ 相关因子表达降低,NO的产生趋于减弱,MHC-Ⅱ的表达趋于上调.Liu 等[29]的研究表明,Notch 信号可能通过某种表观遗传学机制参与 M1 型MΦ 的形成.然而同期,Zhang 等[30]在系统性红斑狼疮中发现Notch1通过调控 MΦ 向 M2b 的极化而参与其病理进程,与上述研究不一致.可能提示,在不同的病理环境下,Notch 可能调控 MΦ 不同的活化状态.
4 、展望.
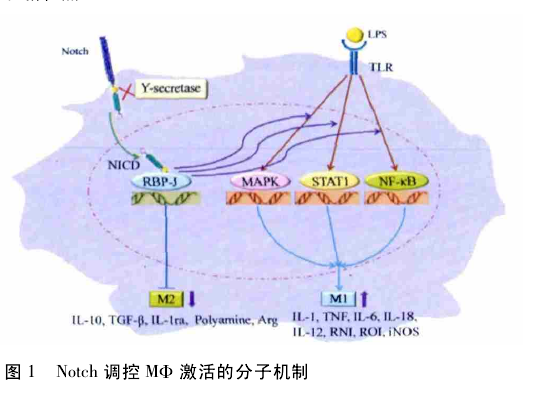
综上所述,MΦ 一类具有高度异质性的固有免疫细胞,在不同的刺激物存在下表现出不同的激活方式.Notch 信号可以通过调控 MΦ 的不同激活模式参与炎症甚至实体瘤的发生,目前已知的调控分子机制如图 1 所示.因而,随着对Notch 信号途径在炎症和肿瘤中对 MΦ 的调控作用及其分子机制深入研究,必将为开发针对炎症治疗的药物提供新思路和新靶点.
参考文献:
[1] Schulz C,Gomez Perdiguero E,Chorro L,et al. A lineage ofmyeloid cells independent of Myb and hematopoietic stem cells[J]. Science,2012,336( 6077) : 86 - 90.
[2] Cumano A,Godin I. Ontogeny of the hematopoietic system[J].Annu Rev Immunol,2007,25: 745 - 785.
[3]Hashimoto D,Chow A,Noizat C,et al. Tissue-resident macrophagesself-maintain locally throughout adult life with minimal contributionfrom circulating monocytes[J]. Immunity,2013,38: 792 - 804.
[4]Yona S,Kim KW,Wolf Y,et al. Fate mapping reveals origins anddynamics of monocytes and tissue macrophage [J]. Immunity,2013,38: 79 - 90.
[5]Murray PJ,Wynn TA. Protective and pathogenic functions of macrophagesubsets[J]. Nat Rev Immunol,2011,11( 11) : 723 - 737.[6]Jenkins SJ,Ruckerl D,Cook PC,et al. Local macrophage proliferation,rather than recruitment from the blood, is a signature of TH2inflammation[J]. Science,2011,332( 6035) : 1284 - 1288.
[7] Martinez FO,Sica A,Mantovani A,et al. Macrophage activationand polarization[J]. Front Biosci,2008,13: 453 - 461.
[8]Ogawa K,Funaba M,Chen Y,et al. Activin A functions as a Th2cytokine in the promotion of the alternative activation of macrophages[J]. J Immunol,2006,177( 10) : 6787 -6794.
[9]Pesce J,Kaviratne M,Ramalingam TR,et al. The IL-21 receptoraugments Th2 effector function and alternative macrophage activation[J]. J Clin Invest,2006,116( 7) : 2044 -2055.
[10]Trujillo G,O'Connor EC,Kunkel SL,et al. A novel mechanism forCCR4 in the regulation of macrophage activation in bleomycin-induced pulmonary fibrosis[J]. Am J Pathol,2008,172( 5) : 1209- 1221.
[11] Martinez FO,Helming L,Gordon S. Alternative activation ofmacrophages: an immunologic functional perspective [J]. AnnuRev Immunol,2009,27: 451 - 483.
[12]Mosser DM,Edwards JP. Exploring the full spectrum of macrophageactivation[J]. Nat Rev Immunol,2008,8( 12) : 958 - 969.
[13]Tien AC,Rajan A,Bellen HJ. A Notch updated[J]. J Cell Biol,2009,184( 5) : 621 - 629.
[14]Sarah Bray. Notch signalling[M]. Oxford: Academic Press,2010: 32 - 59.
[15] Hu X,Chung AY,Wu I,et al. Integrated regulation of Toll-likereceptor responses by Notch and interferon-gamma pathways[J].Immunity,2008,29( 5) : 691 - 703.
[16]Martinez Arias A,Zecchini V,Brennan K. CSL-independent Notchsignalling: A checkpoint in cell fate decisions during development[J]? Curr Opin Genet Dev,2002,12( 5) : 524 -533.
[17]Ohishi K,Katayama N,Shiku H,et al. Notch signalling in hematopoiesis[J]. Semin Cell Dev Biol,2003,14( 2) : 143 -150.
[18] Yamaguchi E,Chiba S,Kumano K,et al. Expression of Notchligands,Jagged1,2 and Delta1 in antigen presenting cells in mice[J]. Immunol Lett,2002,81( 1) : 59 -64.
[19]Nomaguchi K,Suzu S,Yamada M,et al. Expression of Jagged1gene in macrophages and its regulation by haematopoietic growthfactors[J]. Exp Hematol,2001,29( 7) : 850 - 855.
[20]Schroeder T,Kohlhof H,Rieber N,et al. Notch signaling inducesmultilineage myeloid differentiation and up-regulates PU. 1 expression[J]. J Immunol,2003,170( 11) : 5538 -5548.
[21]Ohishi K,Varnum-Finney B,Serda RE,et al. The Notch ligand,Delta-1,inhibits the differentiation of monocytes into macrophagesbut permits their differentiation into dendritic cells[J]. Blood,2001. 98( 5) : 1402 - 1407.
[22]Bai S,Kopan R,Zou W,et al. NOTCH1 regulates osteoclastogenesisdirectly in osteoclast precursors and indirectly via osteoblast lineagecells[J]. J Biol Chem,2008,283( 10) : 6509 - 6518.
[23]Monsalve E,Pérez MA,Rubio A,et al. Notch-1 up-regulation andsignaling following macrophage activation modulates gene expressionpatterns known to affect antigen-presenting capacity and cytotoxicactivity[J]. J Immunol,2006,176( 9) : 5362 - 5373.
[24] Fung E,Tang SM,Canner JP,et al. Delta-like 4 induces Notchsignaling in macrophages: implications for inflammation [J]. Circulation,2007,115( 23) : 2948 - 2956.
[25]Monsalve E,Ruiz-García A,Baladrón V,et al. Notch1 upregulatesLPS-induced macrophage activation by increasing NF-kappaB activity[J]. Eur J Immunol,2009,39( 9) : 2556 -2570.
[26]Xu H,Zhu J,Smith S,et al. Notch-RBP-J signaling regulates thetranscription factor IRF8 to promote inflammatory macrophagepolarization[J]. Nat Immunol,2012,13( 7) : 642 - 650.
[27]Liu Y,Stewart KN,Bishop E,et al. Unique expression of suppressorof cytokine signaling 3 is essential for classical macrophage activationin rodents in vitro and in vivo[J]. J Immunol,2008,180( 9) : 6270- 6278.
[28] Palaga T,Buranaruk C,Rengpipat S,et al. Notch signaling isactivated by TLR stimulation and regulates macrophage functions[J].Eur J Immunol,2008,38( 1) : 174 - 183.
[29]Liu HC,Zheng MH,Du YL,et al. N9 microglial cells polarized byLPS and IL4 show differential responses to secondary environmentalstimuli[J]. Cell Immunol,2012,278( 1 - 2) : 84 - 90.