骨髓增生异常综合征(myelodysplasticsym?drome,MDS)是一种起源于造血干细胞异常克隆的血液系统疾病,主要表现为外周血一系或多系血细胞减少,骨髓活检可见特征性的幼稚前体细胞异常定位病理结构。DNA甲基化转移酶抑制剂(DNAMethyltransferaseInhibitor,DNMTI)的出现为MDS患者提供了新的治疗策略。
DNA甲基化转移酶 1a(DNAMethyltransferase1a,DNMT1a)是一种维持 DNA甲基化状态的酶,DNA在复制时 DNMT1a可以甲基化修饰新合成的子链 DNA,使 DNA维持亲本的甲基化状态。地西他滨(Decitabine,DAC)作为一种 DNMTI可通过降解 DNMT1a,降 低 基 因 组 DNA5′mC 水 平。
Shock等报道了 DNMT1a可以通过 N端的一段信号肽序列定位于线粒体中,与线粒体 DNA结合。线粒体 DNA编码的蛋白参与线粒体氧化呼吸链的电子传递过程,线粒体氧化呼吸复合体功能的异常可以导致线粒体功能的改变。目前国内外有关DAC是否可以通过影响线粒体基因组编码蛋白的表达,从而改变细胞的功能与状态的研究较少。本研究的目的在于探讨 DAC是否存在除基因组整合以外影响线粒体功能的作用。
1 材料与方法
1.1 材料
1.1.1 细胞系 MDS?L细胞受赠于上海交通大学第六人民医院李晓教授。
1.1.2 主要试剂与仪器 细胞培养用 1640培养基、胎牛血清分别购于美国 Gibco和 Hyclone公司。
PI、Brdu、鼠源 anti?Brdu抗体、兔抗鼠二抗?FITC、阿非迪霉素购于美国 Sigma?Aldrich公司。细胞总RNA提取用 Trizol购于美国 Lifeinvitrogene公司,反转录试剂盒 gErasecDNAsynthesis为日本 Takara公司产。qRT?PCR所用 SYBR Green购于日本TOYOBO公司,实时定量 PCR仪 Lightcycle480为瑞士 Roche公司产。ROS检测试剂盒购于北京索莱宝科技有限公司。
1.2 方法
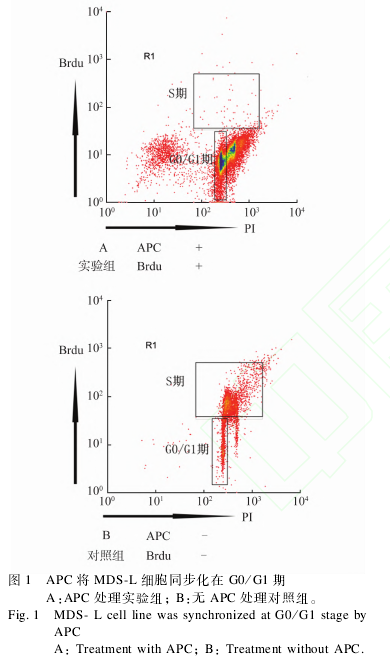
1.2.1 细胞培养及细胞周期同步化 MDS?L细胞系在 37℃、5%CO2条件下培养于含有100U/mL青霉素、100μg/mL链霉素、10%胎牛血清 1640培养基中,间隔2~3d添加1次白介素?3(IL?3)(v∶v=1∶1000),每隔4~5d传代1次。APC以浓度2mg/mL溶解于 DMSO中并保存于 -80℃超低温冰箱。将MDS?L细胞以 5×105个/mL接种在 24孔板中,实验组 MDS?L细胞添加 APC至浓度为20μg/mL,对照组 MDS?L细胞添加 DMSO,37℃、5%CO2条件下培养 24h同步化 MDS?L细胞。
1.2.2 采用 Brdu渗入试验检测细胞周期同步化实验组(APC同步化)细胞与阴性对照组(DMSO)细胞,加入终浓度为15μg/mL的 Brdu(溴化脱氧尿嘧啶),细胞培养箱中孵育3h,4℃条件下70%乙醇固定8h,将固定后的细胞置于 2mol/LHCL处理30min。加抗 Brdu抗体室温孵育 1h。用 FITC标记的兔抗鼠二抗室温孵育 30min,重悬于含有 PI的 PBS中,流式细胞仪 FL1、FL3通道检测 Brdu的渗入量。
1.2.3 DCFH?DA检测 ROS的产生 将 APC同步化后的 MDS?L细胞分别与不同浓度的 DAC作用24h,实验组 DAC浓度为 1.5、5、10、15μmol/L,对照组为无 DAC的 PBS,RPMI1640洗涤细胞 2次,将细胞重悬于 10mmol/LDCFH?DA无胎牛血清1640中,细胞培养箱中孵育 20min,用 4℃预冷的Hank’s缓冲液清洗 3次,最后用 400μLHank’s缓冲液重悬,采用流式细胞仪 FL1检测。
1.2.4 qRT?PCR法检测线粒体 DNA拷贝数及ND1、ND6mRNA转录变化 将同步化的 MDS?L细胞与不同浓度 DAC(0、1.5、5、10、15μmol/L)作用 24h,实验组 DAC浓度为1.5、5、10、15μmol/L,对照组为无 DAC的 PBS。采用 Trizol法提取细胞总 RNA,使用 gErasecDNAsynthesis(Takara)试剂盒将总 mRNA逆转率成 cDNA,以 β?actin为内参行相对定量 PCR方法检测 ND1、ND6基因表达。
采用 TiangenDNA提取试剂盒提取 1×106细胞全基因组 DNA,检测 mtDNA的相对拷贝数变化,HBG为内参基因。以下为 qRT?PCR所需的引物序列:ND1:上游:TGCGAGCAGTAGCCCAAACAAT?CT,下 游:TTATGGCCAAGGGTCATGATGGCA;ND6:上游:TGTGGTCGGGTGTGTTATTATTC,下游:GACAACCATCATTCCCCCTAAAT,β?Actin:上游:GATGGCCACGGCTGCTT,下 游:AGGACTC?CATGCCCAGGAA;MtDNA:上游:CACCCAAGA?ACAGGGTTTGT,下 游:TGGCCATGGGTATGTT?GTTA;HBG:上 游:GCTTCTGACACAACTGTGT?TCACTAGC,下游:CACCAACTTCATCCACGTTC?ACC,总反应体系为 20μL,PCR反应条件为:95℃30s,95℃ 30s,不同引物退火温度设定如下:ND1、ND6、β?Actin:59℃ ,MtDNA、HBG:60℃,72℃延伸 30s,共 38个循环。上述引物扩增片段长度为:ND1:148bp,ND6:91bp,β?Actin:137bp,MtDNA:108bp,HBG:120bp。根据各基因检测所得 Ct值,采用 2-△△Ct法计算相对基因表达量。
1.3 统计学处理 所得数据采用 GraphpadPrism5.0统计软件分析。多样本均数比较采用单因素方差分析,实验组与对照组比较采用 Dunnett?t检验,计量资料以 x珋±s表示。P<0.05为差异有统计学意义。
2 结 果
2.1 APC同步化 MDS?L细胞检测 APC将细胞同步化在 G0/G1期,细胞无法进入 S期。由图 1可见,实验组经 APC处理后细胞周期 S期几乎无细胞存在,而未加 APC处理的对照组 MDS?L细胞按照正常的细胞周期进程,S期可见有大量细胞存在。
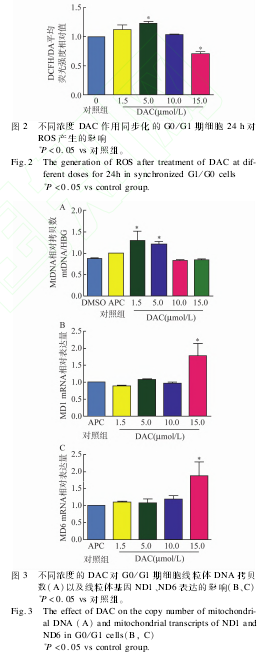
2.2 不同浓度 DAC对同步化 G0/G1期细胞 ROS产生的影响 见图 2。由图 2可见,实验组 MDS?L细胞在5μmol/LDAC作用24h后可以促进同步化的 MDS?L细胞产生 ROS,与对照组相比差异有统计学意义(P<0.05)。当 DAC浓度为 15μmol/L时细胞内 ROS产生较对照组明显较少(P<0.05)。
2.3 不同浓度 DAC对同步化 MDS?L细胞线粒体DNA拷贝数及线粒体编码基因 ND1、ND6转录的影响 与对照组相比,同步化 MDS?L在低浓度DAC(1.5、5μmol/L)条件下可促进线粒体 DNA(MitochondialDNA,MtDNA)拷贝 数 增 加 (P<0.05),但随着 DAC浓度增加,DAC对 mtDNA拷贝数影响不大,见图3A。在高浓度 DAC(15μmol/L)作用下,同步化 MDS?L细胞 ND1、ND6基因转录明显增加,而低浓度 DAC对 ND1、ND6的转录影响不大,见图 3B、C。
3 讨 论
有研究表明,遗传异常在肿瘤发生发展中参与重要的作用。DNA去甲基化药物的出现给 MDS治疗提供了新的策略。地西他滨(DAC)作为美国FDA批准的两种用于临床的 DNA去甲基化药物之一表现出较好的应用前景,部分 MDS患者从中受益。目前有研究认为,DAC发挥抗肿瘤作用具有浓度依赖性,在低浓度下 DAC主要发挥 DNA去甲基化作用,使发生甲基化沉默的抑癌基因重新表达,而高浓度 DAC则通过基因组 DNA整合发挥细胞毒作用。
线粒体是一种存在于胞浆内的细胞器,参与多种生物学过程如能量代谢、自由基产生、钙离子平衡、蛋白质转录后修饰、细胞凋亡等。线粒体DNA拷贝数增减或缺失以及线粒体编码基因的突变可见于多种肿瘤组织中,并与肿瘤的发生进展及预后有关。MDS是一种多发于老年患者的血液系统疾病,通过对 MDS患者的线粒体 DNA测序研究表明,高龄 MDS患者线粒体 DNA突变频率增加,且突变多发生于非编码区域。此外线粒体DNA编码蛋白的表达量以及线粒体 DNA的拷贝数增加异常也可见于 MDS患者。
本实验通过体外干预,使 MDS?L细胞同步化在 G0/G1期,抑制 DAC的 DNA整合作用,以此探讨 DAC是否有对细胞发挥非基因组整合依赖的作用。APC是一种 DNA聚合酶抑制,可以特异性结合 DNA聚合酶,抑制 DNA复制合成从而将细胞周期同步化在 G0/G1期。本实验结果显示,APC可以很有效地将细胞同步化在 G0/G1期。当同步化的 MDS?L细胞给予不同浓度 DAC作用后发现,在低浓度(1.5、5μmol/L)下 DAC可促进同步化细胞ROS产生,但随着浓度的增加,同步化细胞产生的ROS却低于对照组。线粒体内氧化呼吸电子传递是细胞内 ROS主要来源。推测可能与 DAC改变线粒体功能有关。通过检测不同浓度 DAC对同步化 G0/G1细胞线粒体 DNA拷贝数以及线粒体基因 ND1、ND6(NADHdehydrogenase1、6)表达的影响。本实验结果显示,低浓度 DAC(1.5、5μmol/L)可以促进线粒体 DNA拷贝数增加,而高浓度 DAC却无此作用。线粒体 DNA复制具有半自主性,且受 DNA聚合酶 γ催化亚基(mitochondrialDNApolymeraseγcatalyticsubunitA,polgA)调控,polgA基因的甲基化程度与线粒体 DNA拷贝数呈负相关。此外,有研究发现,在纤维原细胞在受到内源性或外源性氧化物质刺激后,均可刺激线粒体DNA拷贝数增加。本实验结果显示,当 DAC浓度为 5μmol/L时,能最大程度促进细胞内 ROS产生,而此浓度对线粒体 DNA拷贝数影响并非最明显。由此可见,低浓度 DAC引起的线粒体 DNA拷贝数增加可能与 DAC去甲基化作用有关。随着浓度增加,DAC引起线粒体 DNA损伤,使线粒体DNA拷贝数减少,抵消了 DAC去甲基化作用所致的线粒体 DNA拷贝数增加的作用。因此,在高浓度 DAC作用,同步化 MDS?L细胞线粒体 DNA拷贝数未见明显改变。虽有研究报道,APC对线粒体功能有影响,但本实验结果显示,APC处理组与DMSO对照组相比,线粒体 DNA拷贝数无明显的变化。ND1、ND6是已报道的两个线粒体 DNA甲基化转移酶参与调控的线粒体基因。低浓度 DAC对线粒体的 ND1、ND6表达无明显影响,相比之下,高浓度 DAC可以促进两者的表达。因氧化呼吸复合体在线粒体内装配异常可影响氧化呼吸链电子传递,所以高浓度 DAC通过改变线粒体基因 ND1、ND6蛋白表达、氧化呼吸复合物装配异常,从而影响线粒体氧化呼吸电子传递,与对照相比,降低ROS的产生。
综上所述,本研究初步探讨了 DAC存在细胞毒以外的其他作用,不同浓度 DAC可以影响线粒体 ROS的产生,改变线粒体 DNA拷贝数及调节线粒体基因表达等作用,为深入研究 DAC的作用机理提供理念依据。
参考文献:
[1]NimerSD.MDS:astemcelldisorderbutwhatexactlyiswrongwiththeprimitivehematopoieticcellsinthisdis?ease[J].HematologyAm SocHematolEducProgram,2008:43?51.doi:10.1182/asheducation2008.1.43.
[2]OgataK,SatohC,TachibanaM,etal.IdentificationandhematopoieticpotentialofCD45?clonalcellswithveryim?maturephenotype(CD45?CD34?CD38?Lin?)inpatientswithmyelodysplasticsyndromes[J].Stemcell,2005,23(5):619?630.
[3]PatelK,DicksonJ,DinS,etal.Targetingof5?aza?2′?deoxycytidineresiduesbychromatin?associatedDNMT1inducesproteasomaldegradationofthefreeenzyme[J].NucleicAcidsRes,2010,38(13):4313?4324.
[4]YamagataY,SzabóP,SzütsD,etal.RapidturnoverofDNAmethylationinhumancells[J].Epigenetics,2012,7(2):141?145.
[5]ShockLS,ThakkarPV,PetersonEJ,etal.DNAmethyltransferase1,cytosinemethylation,andcytosinehydroxymethylationin mammalian mitochondria[J].PNAS,2011,108(9):3630?3635.
[6]Adam?ViziV,TretterL.Theroleofmitochondrialdehy?drogenasesinthegenerationofoxidativestress[J].Neu?rochemInt,2013,62(5):757?763.
[7]LichtensteinAV.Cancer:evolutionary,geneticandepi?geneticaspects[J].ClinEpigenetics,2010,1(3?4):85?100.
[8]FahyJ,JeltschA,ArimondoPB.DNAmethyltransferaseinhibitorsincancer:achemicalandtherapeuticpatento?verviewandselectedclinicalstudies[J].ExpertOpinT?herPat,2012,22(12):1427?1442.
[9]StresemannC,BruecknerB,MuschT,etal.FunctionaldiversityofDNA methyltransferaseinhibitorsinhumancancercelllines[J].CancerRes,2006,66(5):2794?2800.
[10]YuM.Generation,functionanddiagnosticvalueofmi?tochondrialDNAcopynumberalterationsinhumancanc?ers[J].LifeSci,2011,89(3?4):65?71.
[11]JangM,KimSS,LeeJ.Cancercellmetabolism:im?plicationsfortherapeutictargets[J].ExpMolMed,2013,45:45
[12]WulfertM,KüpperAC,TapprichC,etal.AnalysisofmitochondrialDNAin104patientswithmyelodysplasticsyndromes[J].ExpHematol,2008,36(5):577?586.
[13]靳红,丛雅琴,胡晓静,等.骨髓增生异常综合征患者线粒体 DNAD_loop区突变研究[J].山东大学学报:医学版,2008,46(5):453?461.
[14]IusoA,ScaccoS,PiccoliC,etal.Dysfunctionsofcel?lularoxidativemetabolism inpatientswithmutationsintheNDUFS1andNDUFS4genesofcomplexI[J].JBi?olChem,2006,281(15):10374?10380.
[15]LiuP,DempleB.DNArepairinmammalianmitochon?dria:Muchmorethanwethought?[J].EnvironMolMutagen,2010,51(5):417?426.
[16]KellyRD,MahmudA,McKenzieM,etal.Mitochon?drialDNAcopynumberisregulatedinatissuespecificmannerbyDNA methylationofthenuclear?encodedDNApolymerasegammaA[J].NucleicAcidsRes,2012,40(20):10124?10138.
[17]LeeHC,YinPH,LuCY,etal.Increaseofmito?chondriaandmitochondrialDNAinresponsetooxidativestressinhumancells[J].BiochemJ,2000,348(2):425?432.
[18]Camilleri?Broe¨tS,VanderwerffH,CaldwellE,etal.Distinctalterationsinmitochondrialmassandfunctioncharacterizedifferentmodelsofapoptosis[J].ExpCellRes,1998,239(2):277?292.
[19]DiazF,EnríquezJA,MoraesCT.CellslackingRieskeiron?sulfurproteinhaveareactiveoxygenspecies?associ?ateddecreaseinrespiratorycomplexesIandIV[J].MolCellBiol,2012,32(2):415?429.