摘要:纳米孔检测技术以其独特的优势在电分析化学领域引起广泛的关注, 基于此构建的电化学传感器及电化学整流开关已被用于多种目标物分析, 如单分子蛋白检测及DNA测序。纳米孔既可由生物分子制成, 也可由固态材料制备。其中, 固态纳米孔易于修饰, 机械性能、稳定性等相对较好, 应用较为广泛。纳米孔检测技术主要的输出信号为电阻脉冲和电流-电压曲线 (离子整流) , 本文以两种输出信号为重点, 详细介绍了纳米孔检测的原理和应用, 总结了近年来固态单纳米孔通道在分析化学领域的发展, 并对该领域未来的发展趋势和应用前景进行了展望。
关键词:固态单纳米孔; 电阻脉冲; 离子整流; 传感器; 响应开关; 评述;
Application of Single Solid State Nanopore/Nanochannel Based on Polymer Membrane and Glass Nanopipette in Analytical Chemistry
Abstract:Nanopore/nanochannel sensing technique drawing more attention in analytical chemistry due to its unique advantages and the fabricated electrochemical sensors and electrochemical responsive gates have been widely used for more target detection, including single molecule protein and DNA sequencing. Nanopore/nanochannel that used for fabricating electrochemical detection system is mainly divided into biological nanopore and solid state nanopore, and among them, solid state nanopore/nanochannel has a wide range of application due to its inherent properties, such as easy for modification, good mechanical property and stability. Resistive pulse sensing and current-voltage curves ( ion current rectification) are two main methods of nanopore/nanochannel sensing technique used for target analysis, so in this review, we introduced the fundamentals and applications of nanopore sensing technique based on the above two methods. In addition, we concluded the application and development of single state nanopore/nanochannel in recent years, and also gave a brief look at the future challenges and prospects in the development of this field.
Keyword:Single solid nanopore/nanochannel; Resistive pulse; Ion current rectification; Sensor, Responsive gate; Review;
1、引言
生物医学的快速发展和实际需求为生物传感分析提出了新挑战, 疾病早期诊断及复杂生物样品中的灵敏、准确检测的迫切要求促进分析化学传感技术由传统的定性与定量分析向更高的单分子水平检测发展。自库尔特计数器发明以来, 随着单通道电流的记录技术及纳米微加工技术的日趋成熟, 纳米孔检测技术以其独特的优势, 如低成本、操作简单快速、高通量、实时在线、免标记等, 已在分析化学领域获得广泛的关注和发展[1~3].基于纳米孔构建的电化学传感器已被广泛用于检测各种离子、生物分子、单分子蛋白及DNA, 并有望成为第四代DNA测序的新技术[4,5].
目前, 基于纳米孔构建的电化学检测系统主要分为三类:蛋白质纳米孔、固态纳米孔及结合两者优势构建的杂化纳米孔。蛋白质纳米孔包括α-溶血毒素 (α-HL) 、耻垢分枝杆菌毒素蛋白A (Msp A) 、噬菌体phi29连接器马达蛋白 (Phi29 connector) 等, 蛋白质纳米孔的孔径精确、固定, 相关文献报道展示了其在区分短的寡核苷酸片段及单链DNA方面的绝对优势[6,7].但是, 蛋白质纳米孔本身所具有的局限性, 如机械稳定性差、对实验条件 (温度、p H值、盐浓度等) 要求苛刻, 限制了其广泛应用[8~10].相对于蛋白质纳米孔, 以人工材料构筑的固态纳米孔, 包括氮化硅、氧化硅、石墨烯以及有机高分子薄膜[11], 具备较好的机械强度、优异的化学稳定性和热稳定性, 能够适应更加复杂的检测环境, 还可重复使用, 节约成本[12].固态纳米孔的形状和尺寸可调控, 且能在其表面进行灵活的化学或生物修饰, 能够用于多种复杂结构分子目标物的检测。此外, 其稳定的结构有助于与其它微型探测器和探针或分析电路相集成, 构建更加灵敏的单分子检测的生物传感器[12,13].此外, 杂化纳米孔的发展实现了生物孔和固态孔更好的优势结合, 且避免了两者的缺点, 对于单分子目标物的分析检测具有更大优势[14].目前开发的杂化纳米孔主要有α-HL与Si Nx杂化的纳米孔[15], 将碳纳米管嵌入磷脂双分子层或者细胞膜构建的杂化孔[16].随着DNA折纸技术的发展, 三维DNA折纸结构与固态纳米孔相结合构建的杂化纳米孔已见诸报道[17].
本文结合固态纳米孔的独特优势和性能, 总结了固态纳米孔检测的原理及在分析化学领域的应用, 分别介绍了以电阻脉冲作为输出信号的固态纳米孔用于检测单分子DNA、蛋白质及提高检测性能的方法, 对固态纳米孔以离子整流作为输出信号用于响应开关及电化学传感器的构建进行了概述。
2、 电阻脉冲检测方法
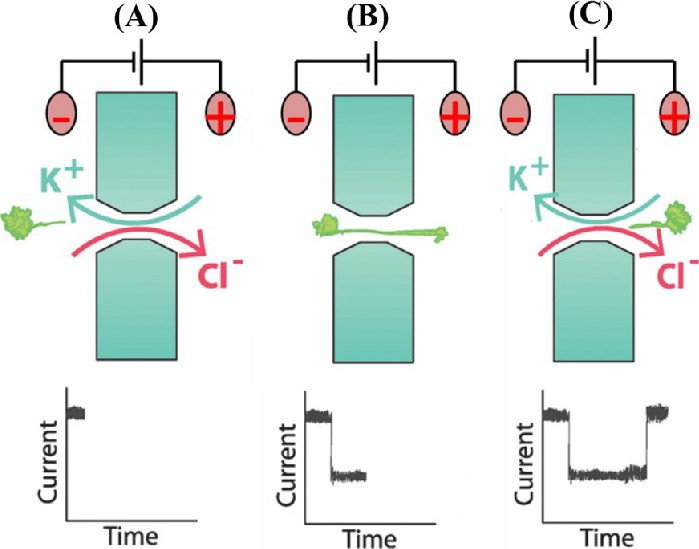
电阻脉冲检测方法具有原理简单、可实时在线监测及响应信号灵敏等优势, 且电流信号经膜片钳系统检测、放大和转换后, 易于读取和分析, 是目前纳米孔分析技术最常用的检测手段[11,18].其工作原理如图1所示, 在纳米通道两段施加恒电位, 在电场作用下, 电解质溶液中的离子流经通道, 产生稳定恒电流 (图1A) .当电解质溶液中存在待测物时, 待测物质能够在扩散作用和电压驱动下进入纳米孔, 堵塞纳米通道, 导致电流降低 (图1B) .当检测物完全离开孔道时, 通道中的电解质状态还原, 电流恢复初始值, 相应的会出现一个电阻的脉冲峰 (图1C) .通过分析脉冲电阻图可以得到3个重要信息:阻塞脉冲电流、分析物滞留时间及阻塞脉冲频率。通过对以上数据进行综合分析即可实现对检测物的定性和定量检测[19].单个分子/纳米颗粒造成纳米孔道尖端离子流的增强或减弱均会产生显着的离子流扰动信号, 可用于获得待测物的结构、长度、表面电荷、振动动频率等信息。
目前, 基于该原理的检测方法常被用于单分子DNA的传感分析, 其对纳米孔的尺寸要求比较严格, 纳米孔的尺寸应尽量与目标检测物在溶液相中的动态尺寸相匹配, 纳米孔的尺寸过大或过小均不能产生理想的电阻脉冲信号[22,23].另外, 目标检测物在电压的驱动作用下穿过纳米孔的速度非常快, 以目前的检测手段及仪器的精度和时间分辨率, 对于实现单分子水平的检测仍然存在挑战, 尤其是对DNA测序过程中单个核苷酸的分辨识别[8,14].通常可通过增加溶液的盐浓度、降低所施加的驱动电压或缩小纳米孔的尺寸, 以降低目标物穿孔的速度, 增强信噪比[24].例如, Xu等[25]开发了一种简单有效的缩小玻璃管纳米孔的尺寸的湿化学方法 (图2A) , 通过硅酸盐的水解反应在纳米孔内壁形成Si O2层, 纳米孔的尺寸缩小到<10 nm.该方法简单有效, 低消耗, 对环境友好, 并且不改变玻璃管纳米孔本身的特性。尺寸缩小之后的纳米孔不仅降低了DNA的迁移速率, 而且显着增强了DNA的迁移信号和信噪比。另外, 很多文献报道已经证实, 在纳米孔表面进行适当的功能化修饰, 不仅能够有效降低纳米孔对目标检测物的非特异性吸附, 防止孔道堵塞, 降低背景信号, 也能够缩小纳米孔径提高检测效果[24].其原理主要依赖纳米孔表面功能化修饰的官能团能够对目标检测物产生相互吸引力 (如氢键、范德华相互作用等) , 降低目标物的穿孔速度。Crick等[26]在玻璃管纳米孔表面覆盖多层石墨烯, 将纳米孔完全覆盖, 通过原位电化学刻蚀, 纳米孔由完全闭合转化为完全打开的状态, 从而精确地制备具有任何孔径尺寸的纳米孔 (图2B) .在较小孔径尺寸下, 能够有效降低DNA穿孔速率, 提高检测效果。此外, 石墨烯表面具有较多的含氧基团, 不仅对DNA迁移速率起调节效果, 而且为纳米孔表面的功能化提供了良好平台。
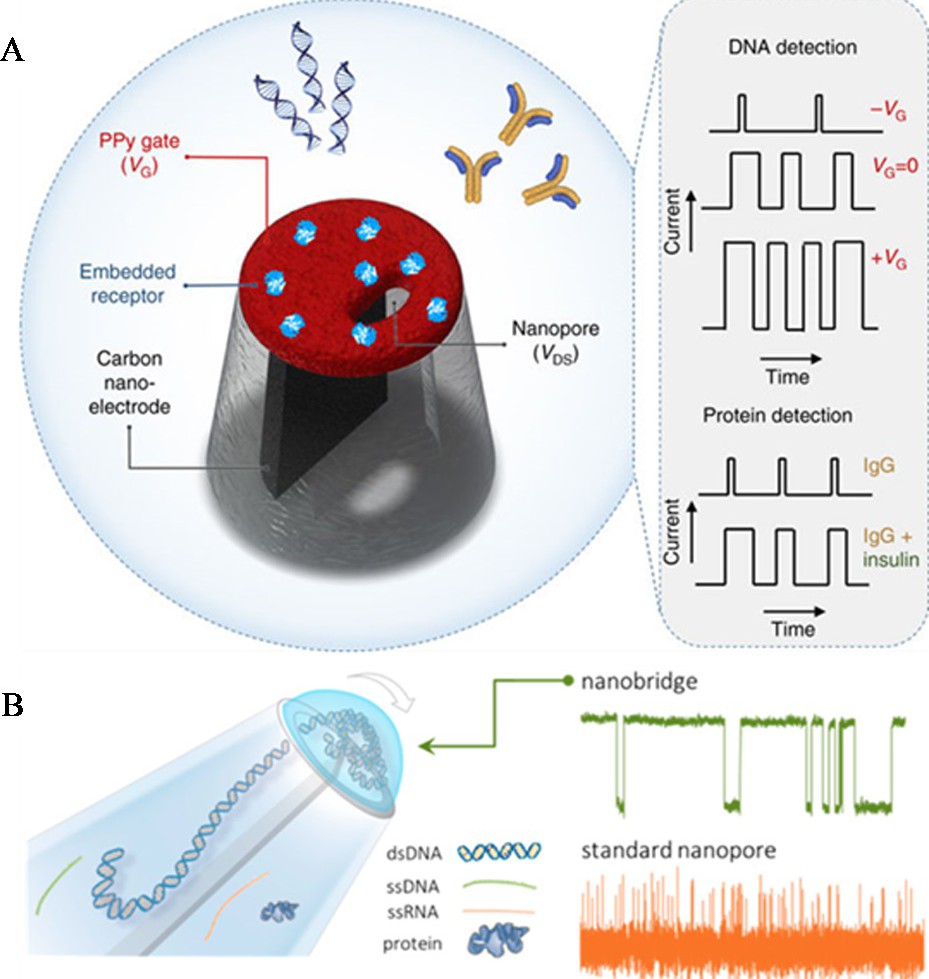
尽管在纳米孔内表面进行功能化和缩小纳米孔的尺寸在降低目标物穿孔速度、提高选择性和灵敏性方面展现出了一定的优势, 但是这些策略通常需要细致、繁琐的优化过程。开发易于制作和功能化的免标记生物传感器, 实现对单分子目标物 (如核酸DNA和蛋白质) 的检测仍然存在挑战。最近的研究表明, 在固态纳米孔道内嵌入一个门电极, 提供一个局部的电场, 可通过调控门电极的电压实现对目标检测物通过纳米孔的速度及迁移方向的有效控制[27,28].此外, 研究人员还将场效应晶体管 (FET) 与纳米孔相结合, 制备出具有离子效应的场效应管, 其物理原理与传统的半导体场效应管相似, 即通过栅极控制离子的流速, 而非电子或者空穴。该传感平台在提高选择性和控制目标物运输方面具有潜在优势。例如, Ren等[29]通过在具有双孔的玻璃管纳米孔的一个孔道内填充碳, 形成碳纳米电极, 然后在玻璃管纳米孔表面沉积一层聚吡咯导电层作为门电极, 构建了一个新的纳米孔扩展的场效应晶体管 (nex FET) .如图3A所示, 通过控制门电压, 可有效控制DNA在单分子水平上通过纳米孔道, 实现对其检测。另外, 聚吡咯栅层适合嵌入可用于选择性分子传感的人工受体, 通过将胰岛素嵌入到聚吡咯导电层, 实现了对抗胰岛素人类免疫球蛋白抗体的检测。nex FET的显着优势是能实时调整纳米孔的离子运输特点, 通过电聚合调整纳米孔的尺寸与分析物相吻合, 在实现高通量检测的同时也可显着增强信噪比。除此之外, 该课题组同样基于两个孔道的玻璃管纳米孔, 通过在其底部滴加一滴液滴形成纳米桥梁, 将核酸DNA分子的转移限制在间隔为20 nm的两个纳米孔之间 (图3B) [30].相对于传统的纳米孔检测方法而言, 该方法使目标分子的移动速率能够降低约3个数量级, 有效增强了对目标物检测的信噪比、分辨率、灵敏度, 降低了检测限;同时, 该方法具有普适性, 可以扩展用于双链DNA、RNA、单链DNA及蛋白质分子的检测。
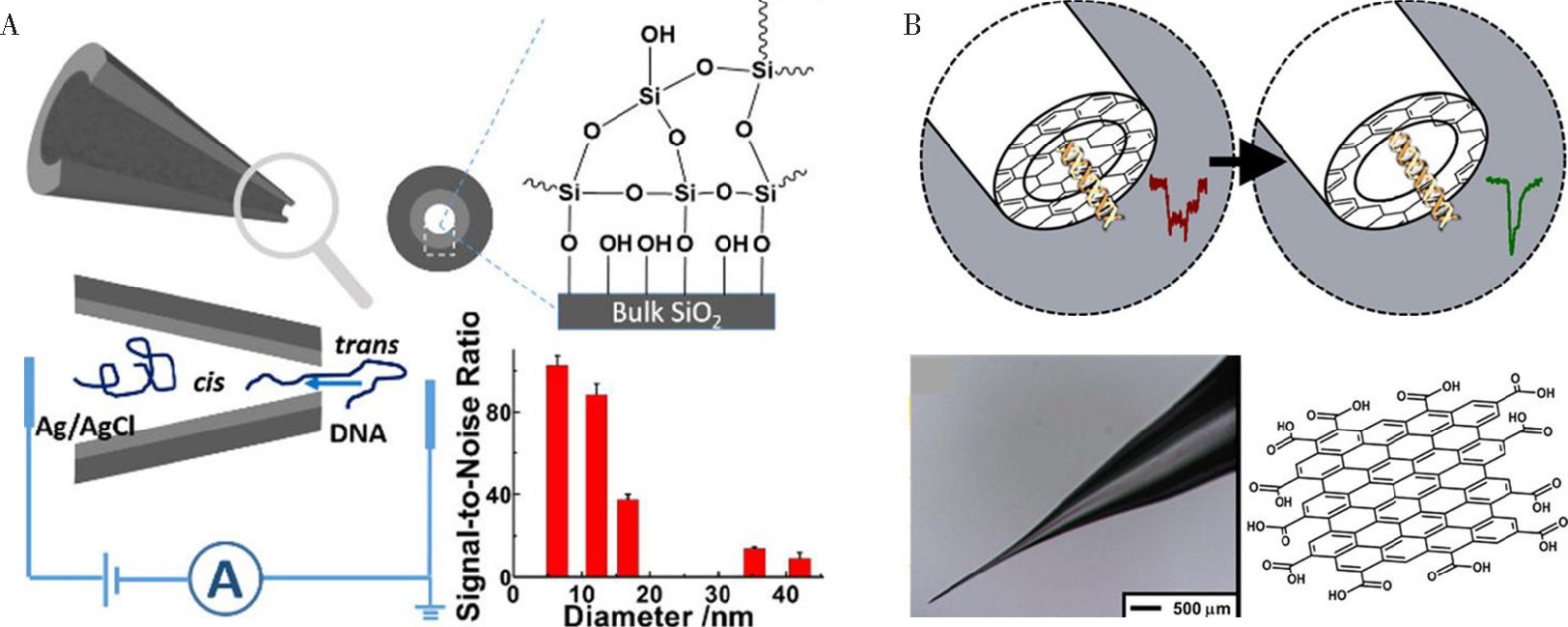
最近, 研究人员开始将纳米孔作为一种确定蛋白物理参数的强有力的分析工具, 如蛋白的尺寸、构象状态、蛋白与蛋白之间的相互作用及与适配体和抗体作用的动力学等[31~33].但是, 相对于DNA而言, 蛋白种确定蛋白物理参数的强有力的分析工具, 如蛋白的尺寸、构象状态、蛋白与蛋白之间的相互作用及与适配体和抗体作用的动力学等[31~33].但是, 相对于DNA而言, 蛋白质具有不同的尺寸、三维结构和不均匀种确定蛋白物理参数的强有力的分析工具, 如蛋白的尺寸、构象状态、蛋白与蛋白之间的相互作用及与适配体和抗体作用的动力学等[31~33].但是, 相对于DNA而言, 蛋白质具有不同的尺寸、三维结构和不均匀的电荷分布, 这些都对纳米孔技术检测蛋白质提出了挑战, 尤其是对相似尺寸的蛋白质检测的弊端就是缺乏选择性。解决以上问题主要有两种方法, 第一种方法是在纳米孔表面修饰特异性的识别受体, 蛋白质与受体特异性结合阻塞纳米孔[34,35];另一种方法是利用DNA作为载体分子分离和检测蛋白[33,36].Bell等[37]通过DNA杂交将190个寡核苷酸 (约7.2 kbp) 组装形成线性的双链DNA作为载体, 在特定位置设置与目标蛋白质结合的特异性结合位点, 从而实现了对链霉亲和素的检测。首先, 将亲和素负载在双链DNA载体上, 其中, 1B、3B和5B分别对应着负载了1个、3个和5个亲和素位点, 链霉亲和素通过特异性结合作用连接到DNA载体上。将DNA载体置于纳米孔检测系统中, 在电压的驱动作用下, DNA载体和蛋白的复合物进入纳米孔道。由于结合的蛋白质分子位于DNA载体的中心位置, 所以在离子电流轨迹中, 蛋白质的特征电流峰信号清晰地出现在DNA信号中间。另外, 随着蛋白绑定位点数量增加, 蛋白信号的振幅增大。利用该纳米孔传感器实现了在混合体系中对目标蛋白的特异性灵敏检测。最近, Lin等[38]采用溶菌酶适配体修饰的金纳米粒子为分子载体, 在复杂体系下实现对溶菌酶的高选择性检测。相对于目标蛋白而言, 适配体修饰的金纳米粒子的引入有效增大了复合物的尺寸, 降低了表面的电荷量, 削弱了目标蛋白与纳米孔之间的相互作用, 显着增强了目标蛋白穿孔频率及信噪比。值得一提的是, 以上的检测只能实现对单一目标蛋白分子的检测。Bell等[39]基于载体-蛋白复合结构的检测方法, 提出了一种数字编码的纳米结构, 实现了在复杂体系中对4种蛋白的同时检测。在该工作中, 在DNA载体中引入了纳米孔可识别的独特的条形码, 当该DNA纳米结构通过固态纳米孔检测时, 含有3个结构单元的条形码对其检测的准确性可达到94%.选取4个条形码, 在每个条形码的特定位置修饰对4种目标抗体具有特异性结合的绑定位点, 将其用于混合体系中四种抗体蛋白的同时检测, 很容易通过条形码的明显差异实现对4种抗体的检测和区分。基于载体-蛋白的检测方法对蛋白质的检测和识别相对比较成熟和准确, 但是这种DNA载体的设计和合成通常比较复杂, 需要基因工程和DNA合成化学等。
除了用于单分子的DNA和蛋白质检测外, 固态纳米孔作为一种强大的分析工具在其它应用方面也展现出了绝对的优势。Chen等[40]利用单个的玻璃管锥形纳米孔作为一个模型系统模拟研究了单膜磷脂囊泡迁移的动力学, 囊泡依次动态通过纳米孔, 可通过周期性出现的离子动态阻塞电流信号进行直观的观察。另外, 通过调控纳米孔的尺寸、溶液p H值、囊泡浓度、施加的电压及纳米孔内表面的荷电性所引起的离子电流阻塞信号振幅和滞留时间的变化, 实现对单膜磷脂囊泡迁移行为的系统研究。该课题组还利用纳米孔分析技术在完全均质的条件下实现了对单分子DNA组装结构的表征[41].他们以DNA杂交链反应 (HCR) 和催化发卡组装 (CHA) 反应为例, 基于纳米孔分析技术的超灵敏特性, 实现了对所形成的DNA纳米结构的表征。当形成的DNA串联体通过纳米孔时, 其在孔道内的滞留时间能够提供所形成的DNA串联体的精确的长度和折叠信息。与原子力显微镜分析技术相比, 纳米孔分析技术可通过对其穿孔事件进行计数和分析实现对单个的串联体信息的检测;与凝胶电泳相比, 可通过电流降低的幅度和滞留时间实现对形成的DNA串联体的大致长度和结构信息的表征, 其超灵敏的检测性同样可以揭示被凝胶电泳及其它分析方法所掩盖的DNA串联体的结构信息。另外, 该检测方法在均一溶液中进行, 最大程度避免了由于孵化、探针标记、无限稀释、电场强度等对DNA串联体结构的损伤。该纳米孔的分析技术同样适用于具有更复杂结构DNA折叠行为的表征。
3、离子整流
离子整流效应是非对称纳米通道的一种独特的性质, 其中, 伏安曲线 (I-V) 是其电化学测定结果的直观表现, 即在两侧电解质溶液完全相同的情况下, 非对称的纳米通道在相同外加电场强度下所测得的电流值有明显差别, 伏安曲线呈一条曲线。在这种情况下, 离子整流比为正负相同的输入电压下所得的两个电流的比值[42,43].Siwy等[42,44]对离子整流现象进行了深入的研究, 并基于纳米孔道小孔的尺寸 (接近双电层) 及表面带电荷的不对称性分布, 提出了广为接受的静电刺齿模型, 对纳米通道内离子整流现象进行了解释。Jiang的课题组[45~47]基于亲疏水特性界面的仿生纳米通道在该领域也开展了一系列卓有成效的工作。自2008年Wang等[48]基于锥形纳米孔的离子整流现象实现了对药物分子的成功检测以来, 离子整流现象作为一种信号输出检测方法被用于对目标探测物进行定性和定量研究[11, 49~51].本部分主要集中介绍了基于离子整流效应的固态纳米孔在分析化学传感领域的应用, 包括玻璃管纳米孔和高分子聚合物纳米孔。
3.1 玻璃管纳米孔
玻璃管纳米孔以离子整流作为信号输出实现对目标物检测的报道比较少, 其主要原因可能是在其表面不容易进行化学修饰。Chen等[52]基于玻璃管纳米孔, 利用聚谷氨酸作为一种非孵化探针, 实现了对Cu2+的快速选择性检测。聚谷氨酸的等电点为3.22, 在中性溶液 (p H=7.0) 中带负电荷, 所以在纳米孔的两端分别加入聚谷氨酸和Cu2+, 在电压的驱动下, 分别向纳米孔的小孔端移动靠近, 且二者在小孔端发生螯合反应, 形成的螯合物阻塞纳米孔, 引起电流值降低。该传感器对Cu2+具有良好的检测效果, 通过调控p H值可再生利用, 具有潜在的应用价值。尽管该方法通过选择不同的螯合剂可实现对其它目标金属离子的检测, 但是其应用仍然存在局限性。所以, 对纳米孔表面进行特定修饰是解决这种局限性、减少非特异性吸附、提高检测性能的重要策略。
最常用的修饰方法主要有静电相互作用和共价键作用。Actis等[53]利用静电作用将壳聚糖和聚丙烯酸修饰在玻璃管纳米孔表面, Cu2+可与其发生螯合作用, 吸附在纳米孔表面, 在中性p H环境下实现对Cu2+的免标记、快速、可逆的检测。基于共价键的相互作用方法中, 最常用的方法就是利用硅氧烷化学反应将3-氨丙基三乙氧基硅烷 (APTES) 修饰在玻璃管纳米孔表面, 引入氨基, 进而在氨基的基础上进行下一步修饰反应。基于该修饰方法, 李耀群课题组通过将不同的特异识别功能的官能团通过硅烷化的氨基修饰在纳米孔表面, 以离子整流为输出信号, 构建了多种电化学传感器, 实现了对葡萄糖[54]、蛋白质[55]等的检测, 同时将具有特定响应信号的聚合物修饰到纳米孔表面, 构建了对p H值、温度等具有单响应或多响应的离子整流器件[56,57].
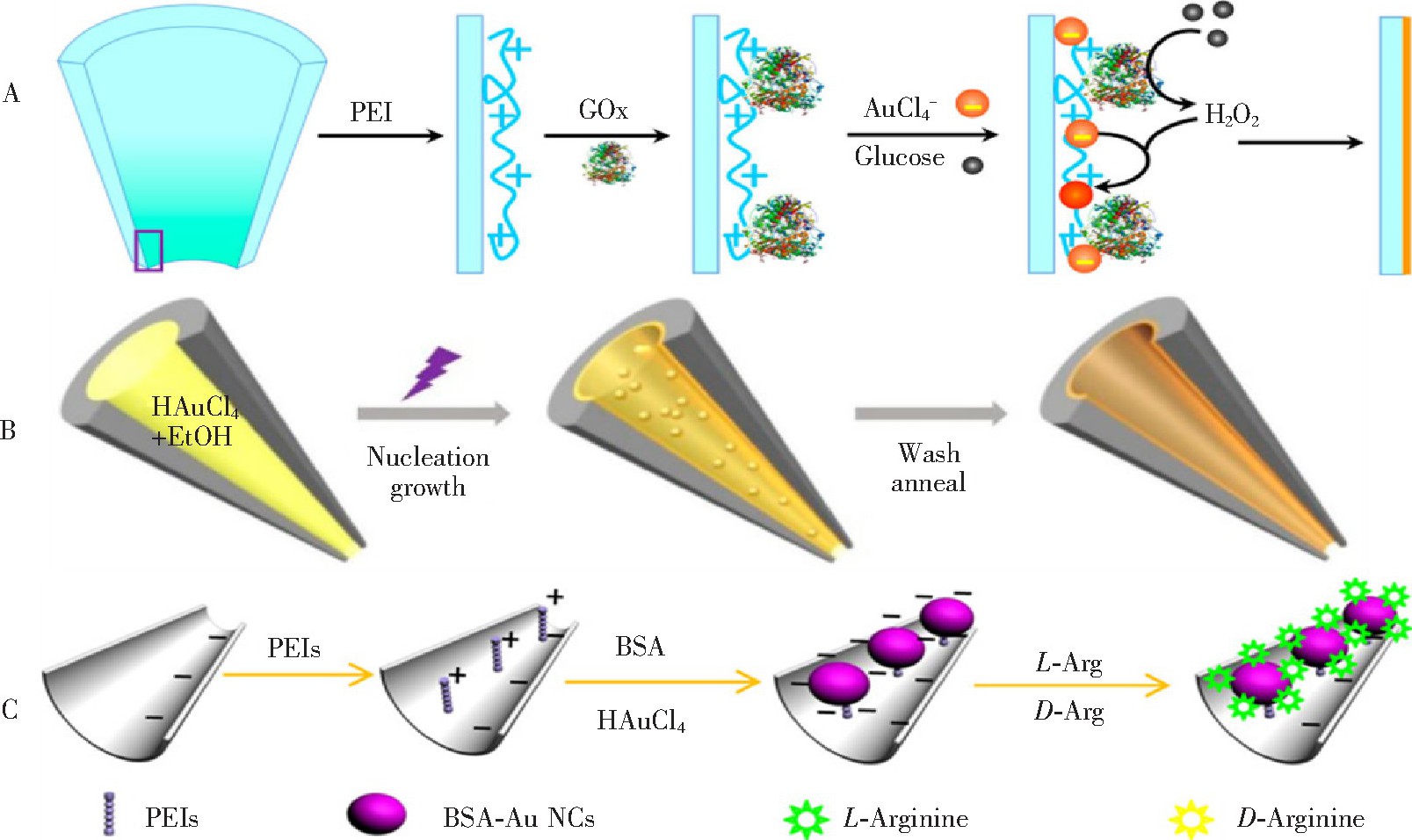
He等[58]开发了3种将金纳米膜沉积在玻璃管纳米孔的内表面可控策略, 为玻璃管纳米孔的进一步修饰应用开辟了新路径。第一种方法如图4A所示, 通过层层组装将聚乙烯亚胺 (PEI) 与葡萄糖氧化酶 (GOx) 通过静电作用修饰到玻璃管纳米孔内表面, GOx在O2存在情况下能够催化氧化葡萄糖产生H2O2, 进而将HAu Cl4还原成Au0.在反应过程中, 与PEI的氨基相互作用的Au Cl4! (作为成核位点) 会优先在玻璃表面还原形成小的Au种子, 可作为催化剂快速生长成为金膜从而覆盖在玻璃管表面。该课题组提出的另一种简单有效的无酶的策略, 玻璃管内表面通过原位化学还原HAu Cl4制备一层超薄的金膜。将聚L-组氨酸修饰在纳米孔的小端作为一个支架材料实现对Au Cl4!的负载, 在盐酸羟胺还原下形成金纳米成核的位点。该方法与上述基于酶反应的方法相比, 更加简单, 整个过程可在2 h内完成[59].基于以上的研究基础, 该课题组又提出了一种简便、直接、快速且环境友好的一步光化学方法在玻璃管表面制备超薄的金膜[60], 如图4B所示。在紫外灯的照射下, HAu Cl4和乙醇作为常规的化学试剂, 被用于在玻璃管纳米孔的内表面缓慢生长超薄的金膜, 由于玻璃管内壁在反应溶液p H≈4.5的条件下带负电荷, 玻璃表面均匀的带负电荷的点或缺陷可作为光化学还原过程中的金纳米成核的位点。该方法对其它带有羟基的光化学试剂, 如乙二醇、乙醇和葡萄糖等也同样起作用, 但反应速率不同。以上方法均实现了在纳米孔表面构筑金纳米薄膜, 为后续在纳米孔表面进一步的修饰提供了更多的可能性, 扩大和推动了基于玻璃管纳米孔构建生物传感器的应用范围。例如, 该课题组在构筑的金膜覆盖的玻璃管纳米孔表面修饰含有巯基的化合物, 如半胱氨酸、硫尿嘧啶等, 研究了其随p H值变化的离子整流特性, 并以此为电化学输出信号构建了生物传感器实现对尿酸的检测[53~55].基于上述3种在玻璃管纳米孔内表面构筑金膜方法, Cao等[61]报道了一种简单、绿色仿生矿化的方法, 利用牛血清蛋白 (BSA) 为还原剂和保护剂, 在纳米孔内表面修饰了一层结构良好的金纳米簇薄膜, 如图4C所示。首先, 在玻璃管纳米孔表面修饰一层带正电的聚合物PEI, 然后通过静电相互作用将BSA组装在纳米孔表面。在p H11.5的条件下, BSA能够将Au?隔离和封装在纳米孔表面, 随后利用其自身的氨基酸残基将Au?原位逐步还原为金纳米簇, 覆盖在纳米孔表面。无论是溶液状态还是在成膜状态, 在激发光照射下, BSA保护的金纳米簇均能发射出很强的荧光, 且荧光强度在较宽的p H值范围内及高盐浓度下非常稳定, 所以可使用荧光显微镜对该方法制备的金膜覆盖的纳米孔修饰的成膜状态进行表征。该方法的另外一个优势是不需要对纳米孔表面形成的金纳米簇膜进行二次修饰, 即实现了合成-修饰一体化, 利用金纳米簇覆盖的纳米孔表面BSA中离子化的羧基 (COO!) 与精氨酸中的胍基通过协同作用所形成的独特的离子对, 实现了对手性氨基酸分子精氨酸的分离和检测。
最近, 空间限域电化学引起研究者的广泛关注。研究人员利用纳米孔有限的空间实现了对个体生物分子的高通量电化学传感。Long的课题组[62]提出并扩展了纳米孔中电化学限制域效应的概念, 从纳米孔和分析物之间的强相互作用、电子传递过程以及纳米孔内的亚波长光3个方面对其进行了阐述, 并将其应用于开发新的基于纳米孔的传感机制。另外, 该课题组将“电化学过程”限域在单个纳米孔道内, 通过“化学-电化学”制备的策略, 实现了在普通化学实验室即可构建含有电活性尖端的无线限域纳孔电极, 具有高时间分辨及高电流分辨能力[63~66].
3.2 高分子聚合物纳米孔
基于高分子聚合物纳米孔的离子整流电化学传感器报道的相对较多, 其主要原因是纳米孔的构筑可通过化学腐蚀实现, 简单方便;另外, 可通过控制刻蚀时间和刻蚀的方法制备出不同形状、尺寸可调的纳米通道;最重要的是, 刻蚀后的纳米孔表面含有丰富的裸露的化学基团, 易于后续的表面功能化, 为开发智能纳米通道体系提供了良好的材料基础[67~69].目前, 应用最多、研究最广的高分子类聚合物纳米孔为聚对苯二甲酸乙二醇酯 (PET) 材质, 通过NAOH刻蚀制备的PET纳米孔表面含有?OH和?COOH等活性基团, 将特定的识别单元分子修饰在纳米通道表面可实现对多种目标物, 包括离子、生物分子、蛋白质及DNA的特异性灵敏检测[43,70,71].
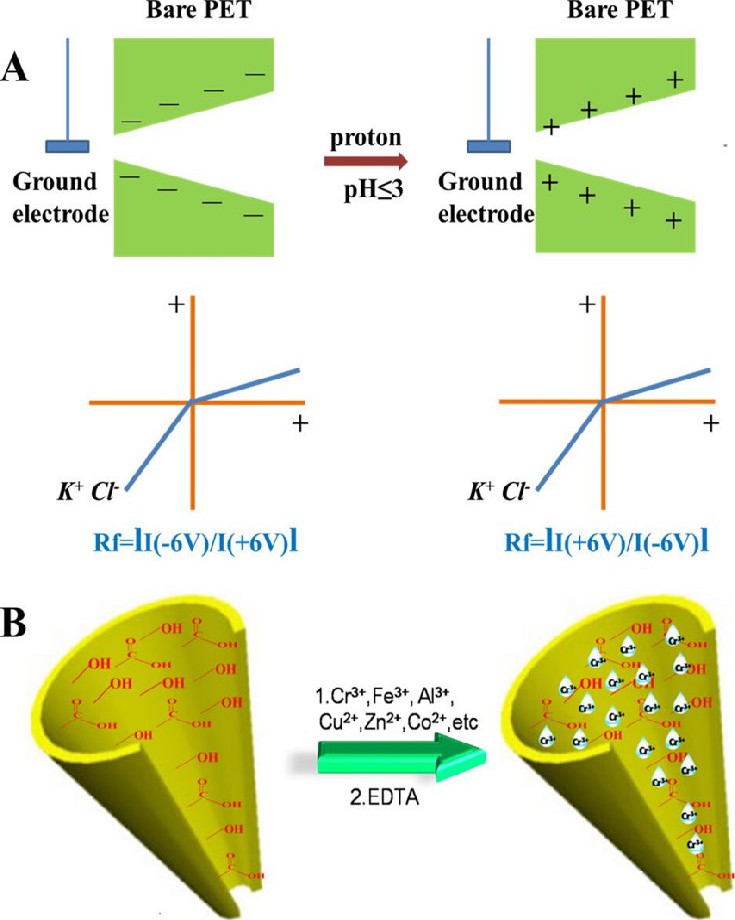
通常, 在p H≤3条件下, 刻蚀制备的PET锥形纳米孔不会表现出或者表现出非常弱的离子整流现象, 主要是因为随着缓冲溶液的p H值降低到羧基的p Ka值, 纳米孔表面的电荷降低到零[69].本研究组的研究发现, 在p H≤3且离子强度较低的缓冲溶液中, PET锥形纳米孔表现出与表面带正电荷的纳米孔同样明显的离子整流现象, 如图5A所示, 原来带负电荷的表面在p H≤3时表面表现出正电荷, 电流-电压曲线发生反转[72].进一步研究发现, 该现象的出现必须满足3个条件, 即扫描电压足够大、溶液离子强度要适当、电解液的p H≤3.研究结果表明, 在p H≤3条件下, PET纳米孔表面带正电所引起的离子整流现象是由于纳米孔表面的羧基或羟基的氢进一步质子化造成的。该研究结果丰富了纳米孔技术的知识, 表明基于锥形纳米通道构建的依赖于p H值变化的离子整流纳米二极管无需对PET膜进行任何修饰即可实现。在随后的研究中发现, 未修饰的PET纳米孔表面的羧基和羟基对多种金属离子表现出良好的螯合能力, 吸附在纳米孔表面, 且能引起纳米孔离子整流的变化, 该结果与文献[73, 74]报道一致。基于该原理可实现对特定金属离子的检测, 选择性是关键。在p H=8的条件下, 强的螯合剂EDTA对Cr3+的螯合能力比纳米孔表面的羧基及羟基的螯合能力弱, 但是EDTA对其它干扰金属离子的螯合能力强。因此, 将EDTA引入该纳米孔检测系统可实现对Cr3+的特异性灵敏检测 (图5B) .该方法避免了传统的方法在纳米孔表面的繁琐的修饰过程, 更加简单、方便, 且通过结合特定的螯合剂可实现对特定金属离子的选择性灵敏检测[75].
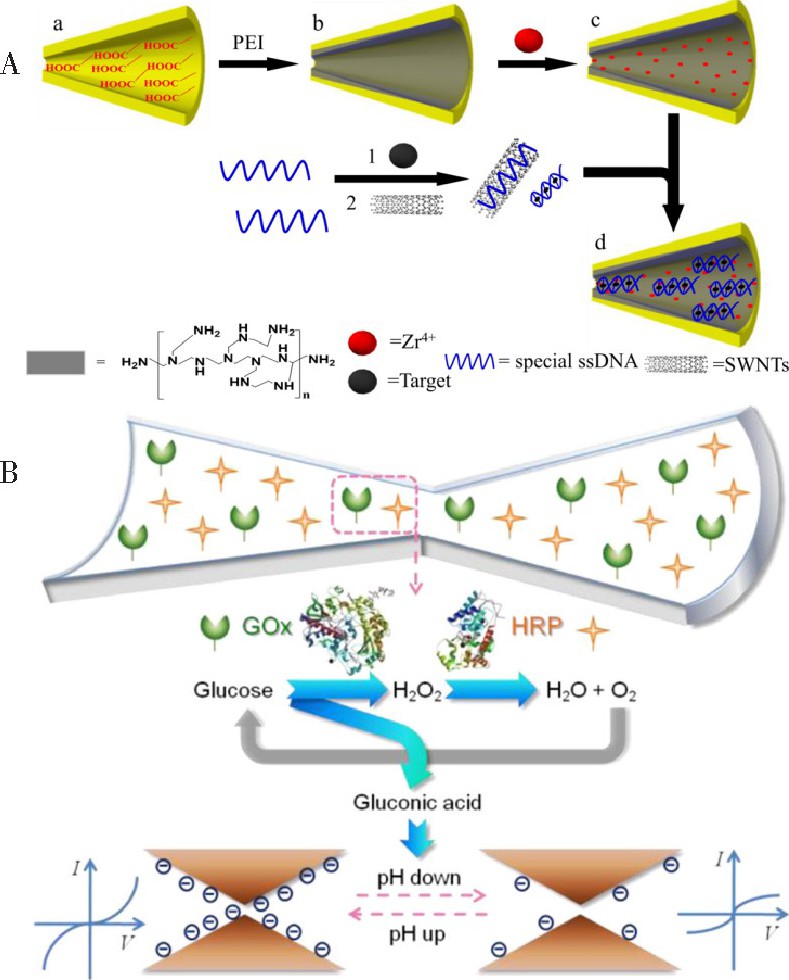
基于纳米孔表面的羧基或羟基进行特定的化学修饰构建电化学传感器和离子整流器件是目前研究的主流趋势。本课题组基于静电相互作用, 将PEI及Zr4+通过层层自组装修饰在PET纳米孔的内表面, 通过特定的单链DNA及碳纳米管, 实现对目标物的检测[40,67].当目标物存在时, 其能与单链DNA相互作用, 使得单链DNA杂交形成双链DNA.Zr4+对含有磷酸基团的化合物具有很强的亲和力[76], 能够结合DNA.所以, 在纳米孔检测系统中, DNA在电压的驱动作用下能够进入纳米孔道内且吸附在内表面, 引起纳米孔离子整流现象的改变, 从而实现对目标物的检测。为降低目标物检测的背景信号及消除由于单链DNA的吸附造成的影响, 在检测过程中, 我们引入碳纳米管来选择性地吸附单链DNA.通过对捕获探针DNA的设计, 引入富T的DNA单链及ATP的适配子, 实现了金属离子Hg2+及生物分子ATP的检测, 且检测性能良好 (图6A) [43,70].同样, 通过静电相互作用及层层自组装, Wen等[77]将磺化杯芳烃修饰在PET纳米孔表面, 实现了对乙酰胆碱的高灵敏检测。另外, 利用EDC/NHS的偶联反应, 将具有特定识别功能的化合物、生物分子 (DNA, 酶等) 修饰在纳米孔的表面构建仿生的纳米离子通道, 实现了对多种目标物, 如金属离子、生物分子等的检测。Jiang的课题组[45,78]将环糊精修饰在PET锥形纳米孔表面实现了对手性生物分子组氨酸、色氨酸等的分离检测。Lin等[79]刻蚀制备了沙漏型PET纳米孔, 将GOx和辣根过氧化物酶 (HRP) 修饰在纳米孔的表面, 实现了对葡萄糖的检测 (图7B) .葡萄糖被GOx氧化成葡萄糖酸和H2O2, H2O2进一步被HRP降解变为H2O和O2.在该反应过程中, HRP不仅能够有效降解H2O2, 促进GOx对葡萄糖氧化产生更多的葡萄糖酸, 且降解H2O2产生的O2能满足GOx催化葡萄糖反应对O2的需求。在整个反应过程中, 积累产生的葡萄糖酸使得纳米孔周围微环境的p H值降低。由于纳米孔道对微环境的改变具有独特的阳离子选择性能和高的灵敏度, 通过监控离子电流信号, 所构建的纳米孔传感器对葡萄糖展现出了良好的响应性能。
基于高分子聚合物纳米孔的离子整流效应同时也被用于蛋白质的检测, Ensinger等[80~83]做了许多相关工作。他们将与蛋白质具有特异性识别作用的化合物或蛋白分子修饰在纳米孔表面, 实现目标蛋白的特异性结合, 通过纳米孔离子整流的变化对其检测。例如, 他们基于糖类化合物与外源凝集素的特异性作用, 将HRP (含有甘露糖残基) [80]和β-D-甘露糖苷[81]修饰在PET纳米孔表面, 实现对伴刀豆蛋白A的特异性检测。将溶菌酶的适配体修饰在PET纳米孔表面, 通过溶菌酶与适配体的特异性生物结合作用实现对溶菌酶的检测[82].另外, 除了传统的配体-受体相互作用用于目标蛋白的检外, 他们还将金属螯合剂配体修饰在纳米孔表面, 通过铁离子辅助形成的复合物实现对乳铁蛋白的特异性检测[83].该方法可扩展用于构建其它的基于金属离子亲和的仿生纳米孔检测系统用于其它生物分子的特异结合和识别。随后, 基于镍与组氨酸的特异性结合能力, 将镍-次氮基三乙酸 (Ni-NTA) 的复合物被修饰到纳米孔表面用于组氨酸标记蛋白的识别和检测[36].
除了传感器的构建以外, 研究人员还将各种具有响应功能的高分子聚合物及分子修饰在纳米孔表面, 用于构建刺激响应型的离子整流开关器件。目前已经开发出对电压、离子、p H值、温度、光、气体等单响应或多响应的离子整流开关[84~87].本研究组以PET纳米孔表面的羧基和羟基作为光活性的位点, 通过自引发的光嫁接和光聚合反应, 将对CO2和温度双重响应的聚甲基丙烯酸N, N-二甲氨基乙酯 (PDMAEMA) 修饰到锥形纳米孔表面, 构建了对CO2和温度具有双重响应的纳米孔离子整流开关[88].在溶液中充CO2气体时, 纳米孔表面修饰的聚合物的叔胺基团发生质子化, 纳米孔表面带正荷, 使得整流信号发生变化。另外, 该聚合物的低临界溶液温度 (LCST) 约为40℃, 温度的刺激同样使得该聚合物的构象发生变化。当温度高于LCST时, 聚合物呈现折叠状态;相反, 当温度低于LCST时, 聚合物呈现舒展状态。聚合物折叠和舒展状态使得纳米孔的孔径发生变化, 从而引起离子整流的变化。
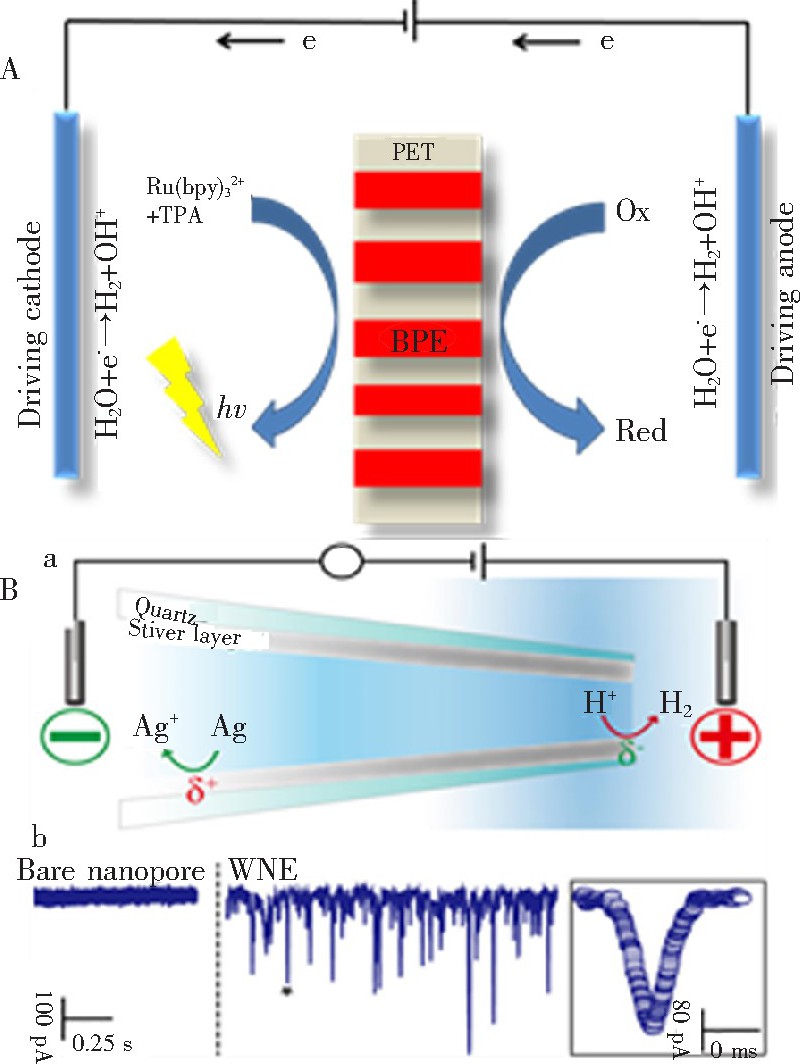
4、与双极电极相结合的检测方法
双极电极是一个置于溶液中的电子导体, 不通过导线接触, 在其两端施加电压时, 能够同时具有阳极和阴极的作用。双极电极具有结构简单, 制作加工方便, 无需直接导线连接便可使双极电极的两极发生电化学氧化–还原反应等诸多优势, 被广泛应用于材料的合成及非对称修饰、电化学传感免疫分析等领域, 是电化学研究新的热点方向[89,90].最近, 本课题组利用PET纳米通道易于刻蚀制备、孔径可调、绝缘性及机械性能良好等优势, 在纳米孔道沉积金纳米棒制备了纳米级封闭式双极电极阵列, 以电化学发光作为信号输出, 实现了对多种目标物的灵敏检测[91], 如图7A所示。该方法制备双极电极简单快速, 并且双极电极尺寸可通过PET的刻蚀时间进行调控, 克服了传统光刻蚀方法制备微米级或纳米级双极电极的局限性, 是纳米孔通道应用的新途径。Long的课题组[92]将银层覆盖在玻璃管纳米孔内构建了一个无线的基于开放式双极电极的纳米孔传感器, 实现了对Hg2+的检测, 如图7B所示。当施加驱动电压时, 覆盖的银层作为双极电极, 在双极电极阳极银被氧化变为银离子, 在双极电极的阴极, 氢离子被还原为氢气。当检测物Hg2+存在时, 其还原电势比H+低, 能够在双极电极的阴极优先被还原, 使得产生的H2减少, 电流扰动变小。基于此可实现对Hg2+等还原电势比H+低的检测物的检测。该工作利用纳米孔尖端极化作用产生表面聚集负电荷纳米氢气泡, 从而产生管尖离子流增强信号。这一纳米孔创新机制被进一步应用于单个细胞内NADH的选择性测量[20].
5、总结与展望
纳米孔分析检测技术作为一个强有力的技术手段, 在解决分析化学的基本问题, 如提高检测的灵敏度实现目标物单分子水平上的检测、提高检测的选择性能、抗干扰能力以及高通量实时在线检测等方面展现出了突出的优势, 并取得了突破性的进展, 所构建的电化学传感器被广泛用于目标物的定性及定量分析。实现在单分子水平上理解分子结构和功能以及实时生物分析是分析化学发展的重要方向, 纳米孔分析技术以其独特的性能在该领域展现出了卓越的优势。近年来, 科研人员对固态纳米孔在分析化学领域的应用进行了深入的研究并取得了显着的成果, 包括以电阻脉冲作为输出信号的单分子检测、以离子整流信号为输出构建的电化学传感器及响应器件的构建, 并且基于纳米孔的第四代DNA测序仪已经问世。但是, 仍然有很多关键性的问题亟待解决, 例如固态纳米孔制备的重现性问题, 固态纳米孔表面的可控修饰问题, 将纳米孔检测技术与其它技术手段 (如表面增强拉曼、石英晶体微天平、光谱化学等) 结合, 扩展其应用范围到活体、细胞、单分子等的实时在线分析检测等。目前, 以光学作为检测信号的固态纳米孔也已取得了一定的进展[93], 固态纳米孔也在能源转换及反应机理研究中获得应用[94].可以相信, 随着纳米科技的不断发展及纳米孔理论的进一步完善, 更多更具创新性的检测手段将与纳米孔子相结合, 终将推动纳米孔分析检测技术向更高、更深的水平发展, 应用前景更加广阔。
参考文献
[1] Branton D, Deamer D W, Marziali A, Bayley H, Benner S A, Butler T, di Ventra M, Garaj S, Hibbs A, Huang X, Jovanovich S B, Krstic P S, Lindsay S, Ling X S, Mastrangelo C H, Meller A, Oliver J S, Pershin Y V, Ramsey J M, Riehn R, Soni G V, Tabard-Cossa V, Wanunu M, Wiggin M, Schloss J A.Nat, Biotechnol, 2008, 26 (10) :1146-1153
[2] Neher E, Sakmann B.Nature, 1976, 260 (5554) :799-802
[3] Cao C, Ying Y L, Hu Z L, Liao D F, Tian H, Long Y T.Nat.Nanotechnol., 2016, 11 (8) :713-718
[4] Eisenstein M.Nat.Biotechnol., 2012, 30 (4) :295-296
[5] Fuller C W, Kumar S, Porel M, Chien M, Bibillo A, Stranges P B, Dorwart M, Tao C, Li Z, Guo W, Shi S, Korenblum D, Trans A, Aguirre A, Liu E, Harada E T, Pollard J, Bhat A, Cech C, Yang A, Arnold C, Palla M, Hovis J, Chen R, Morozova I, Kalachikov S, Russo J J, Kasianowicz J J, Davis R, Roever S, Church G M, Ju J.Proc.Natl.Acad.Sci.USA, 2016, 113 (19) :5233-5238
[6] YANG Jie, LI Shuang, WU Xue-Yuan, LONG Yi-Tao.Chinese J.Anal.Chem., 2017, 45 (12) :1766-1775杨洁, 李爽, 武雪原, 龙亿涛。分析化学, 2017, 45 (12) :1766-1775
[7] Rauf S, Zhang L, Ali A, Ahmad J, Liu Y, Li J.Anal.Chem., 2017, 89 (24) :13252-13260
[8] Haque F, Li J, Wu H.C, Liang X J, Guo P.Nano Today, 2013, 8 (1) :56-74
[9] Liu G, Zhang L, Dong D, Liu Y, Li J.Anal.Methods, 2016, 8 (39) :7040-7046
[10] YIN Xiao-Hong, ZHU Xin-Yu, GU Jing, ZHANG Xin, ZHU Zhi-Wei, SHAO Yuan-Hua.Chinese J.Anal.Chem., 2013, 41 (5) :633-640阴笑弘, 朱新宇, 顾菁, 张欣, 朱志伟, 邵元华。分析化学, 2013, 41 (5) :633-640
[11] Miles B N, Ivanov A P, Wilson K A, Dogan F, Japrung D, Edel JB.Chem.Soc.Rev., 2013, 42 (1) :15-28
[12] Yu J, Wang L, Liu Q.Mater.Rev., 2015, 29 (3A) :110-115
[13] ZHAN SHeng-Xin, ZHANG Xiao-Hui, WANG Na, YANG Xiao-Rui, GUO Ming.Mater.Rev., 2012, 26 (19) :13-16战胜鑫, 张晓辉, 王娜, 杨晓蕊, 郭明。材料导报, 2012, 26 (19) :13-16
[14] Shi W, Friedman A K, Baker L A.Anal.Chem., 2017, 89 (1) :157-188
[15] Hall A R, Scott A, Rotem D, Mehta K K, Bayley H, Dekker C.Nat.Nanotechnol., 2010, 5:874-877
[16] Geng J, Kim K, Zhang J, Escalada A, Tunuguntla R, Comolli L R, Allen F I, Shnyrova A V, Cho K R, Munoz D, Wang Y M, Grigoropoulos C P, Ajo-Franklin C P, Frolov V A, Noy A.Nature 2014, 514:612-615
[17] Bell N A, Engst C R, Ablay M, Divitini G, Ducati C, Liedl T, Keyser U F.Nano Lett., 2012, 12:512-517
[18] Zhang L, Zhang K, Liu G, Liu M, Liu Y, Li J.Anal.Chem., 2015, 87 (11) , 5677-5682
[19] Harrell C C, Choi Y, Horne L P, Baker L A, Siwy Z S, Martin C R.Langmuir, 2006, 22 (25) :10837-10843
[20] Ying Y L, Hu Y X, Gao R, Yu R J, Gu Z, P.Lee L, Long Y T.J.Am.Chem.Soc., 2018, 140 (16) :5385-5392
[21] Liu S C, Li M X, Li M, Wang Y, Ying Y L, Wan Y J, Long Y T.Faraday Discuss., 2018, DOI:10.1039/C8FD00023A
[22] ZHANG Si-Qi, SUN Ting, WANG Ee-Kang, WANG Jia-Hai.Chinese Sci.Bull., 2015, 60 (4) :422张思奇, 孙挺, 汪尔康, 王家海。科学通报, 2015, 60 (4) :422
[23] CHEN Wen-Hui, LUO Jun, ZHAO Chao.Sci Sin.Vitae, 2014, 44 (7) :649-662陈文辉, 罗军, 赵超。中国科学:生命科学, 2014, 44 (7) :649-662
[24] Luan B, Stolovitzky G, Martyna G.Nanoscale, 2012, 4 (4) :1068-1077
[25] Xu X, Li C, Zhou Y, Jin Y.ACS Sensors, 2017, 2 (10) :1452-1457
[26] Crick C R, Sze J Y, Rosillo-Lopez M, Salzmann C G, Edel J B.ACS Appl.Mater.Interfaces, 2015, 7 (32) :18188-18194
[27] Xie P, Xiong Q, Fang Y, Qing Q, Lieber C M.Nat.Nanotechnol., 2012, 7 (2) :119-125
[28] Liu Y, Yobas L.ACS Nano, 2016, 10 (4) :3985-3994
[29] Ren R, Zhang Y, Nadappuram B P, Akpinar B, Klenerman D, Ivanov A P, Edel J B, Korchev Y.Nat.Commun., 2017, 8 (1) :586
[30] Cadinu P, Paulose Nadappuram B, Lee D J, Sze J Y, Campolo G, Zhang Y, Shevchuk A, Ladame S, Albrecht T, Korchev Y, Ivanov A P, Edel J B.Nano Lett, 2017, 17 (10) :6376-6384
[31] Yu R J, Ying Y L, Hu Y X, Gao R, Long Y T.Anal.Chem., 2017, 89 (16) :8203-8206
[32] Talaga D S, Li J.J.Am.Chem.Soc., 2009, 131 (26) :9287-9297
[33] Bell N A W, Keyser U F.J.Am.Chem.Soc., 2015, 137 (5) :2035-2041
[34] Howorka S, Siwy Z S.Nat.Biotechnol., 2012, 30 (6) :506-507
[35] Wei R, Gatterdam V, Wieneke R, Tampe R, Rant U.Nat.Nanotechnol., 2012, 7 (4) :257-263
[36] Kong J, Zhu J, Keyser U F.Chem.Commun., 2017, 53 (2) :436-439
[37] Bell N A, Keyser U F.J.Am.Chem.Soc., 2015, 137 (5) :2035-2041
[38] Lin X, Ivanov A P, Edel J B.Chem.Sci., 2017, 8 (5) :3905-3912
[39] Bell N A W, Keyser U F.Nat.Nanotechnol., 2016, 11 (7) :645-651
[40] Chen L, He H, Jin Y.Anal.Chem., 2015, 87 (1) :522-529
[41] Zhu Z, Zhou Y, Xu X, Wu R, Jin Y, Li B.Anal.Chem., 2018, 90 (1) :814-820
[42] Siwy Z S.Adv.Funct.Mater., 2006, 16 (6) :735-746
[43] Zhang S, Bao A, Sun T, Wang E, Wang J.Biosens.Bioelectron., 2015, 63:287-293
[44] Siwy Z, Heins E.Harrell C C, Kohli P, Martin C R.J.Am.Chem.Soc., 2004, 126 (35) :10850-10851
[45] Han C, Hou X, Zhang H, Guo W, Li H, Jiang L.J.Am.Chem.Soc., 2011, 133 (20) :7644-7647
[46] Sun Z, Han C, Song M, Wen L, Tian D, Li H, Jiang L.Adv.Mater., 2014, 26 (3) :455-460
[47] Gao L, Li P, Zhang Y, Xiao K, Ma J, Xie G, Hou G, Zhang Z, Wen L, Jiang L.Small, 2015, 11 (5) :543-547
[48] Wang J, Martin C R.Nanomedicine, 2008, 3 (1) :13-20
[49] Long Z, Zhan S, Gao P, Wang Y, Lou X, Xia F.Anal.Chem., 2018, 90 (1) :577-588
[50] Guo W, Tian, Y, Jiang L.Accounts Chem.Res., 2013, 46 (12) :2834-2846
[51] Zhang H, Tian Y, Jiang L.Nano Today, 2016, 11 (1) :61-81
[52] Chen L, He H, Xu X, Jin Y.Anal.Chim.Acta, 2015, 889:98-105
[53] Actis P, Vilozny B, Seger R A, Li X, Jejelowo O, Rinaudo M, Pourmand N.Langmuir, 2011, 27 (10) :6528-6533
[54] Zhao S, Zheng Y B, Cai S L, Weng Y H, Cao S H, Yang J L.Li Y Q.Electrochem.Commun., 2013, 36:71-74
[55] Cai S L, Cao S H, Zheng Y B, Zhao S, Yang J L, Li Y Q.Biosens.Bioelectron., 2015, 71:37-43
[56] Zhang L X, Cao X H, Zheng Y B, Li, Y Q.Electrochem.Commun, 2010, 12 (9) :1249-1252
[57] Zhang L X, Cai S L, Zheng Y B, Cao X H, Li Y Q.Adv, Funct.Mater, 2011, 21 (11) :2103-2107
[58] He H, Xu X, Jin Y.Anal.Chem., 2014, 86 (10) :4815-4521
[59] He H, Xu X, Wang P, Chen L, Jin Y.Chem.Commun, 2015, 51 (10) :1914-1917
[60] Xu X, He H, Jin Y.Anal.Chem., 2015, 87 (6) :3216-3221
[61] Cao S, Ding S, Liu Y, Zhu A, Shi G.Anal.Chem., 2017, 89 (15) :7886-7892
[62] Ying Y L, Gao R, Hu Y X, Long Y T.2018, DOI:10.1002/smtd.20170039
[63] Gao R, Ying Y L, Li Y J, Hu Y X, Yu R J, Lin Y, Long Y T.Angew.Chem.Int.Ed., 2018, 57 (4) :1011-1015
[64] Gao R, Lin Y, Ying Y L, Liu X Y, Shi X, Hu Y X, Long Y T, He T.Small, 2017, 13 (25) :1700234
[65] Lin Y, Ying YL, Long Y T.Curr.Opin.Electrochem., 2017, 7:172-178
[66] Ying Y L, Long Y T.Sci.China Chem., 2017, 60 (9) :1187-1190
[67] GUO Zhi-Jun, WANG Jia-Hai, HU Yao-Hui, WANG Er-Kang.Prog.Chem., 2011, 23 (10) :2103-2112郭志军, 王家海, 胡耀辉, 汪尔康。化学进展, 2011, 23 (10) :2103-2112
[68] Hou G, Peng Z, Tian Y, Zhang H, Jiang L.Chinese Sci.Bull., 2013, 58 (13) :1473-1482
[69] Yang L, Zhai Q, Li G, Jiang H, Han L, Wang J, Wang E.Chem.Commun., 2013, 49 (97) :11415-11417
[70] Zhai Q, Zhang S, Jiang H, Wei Q, Wang E, Wang J.J.Mater.Chem.B, 2014, 2 (37) :6371-6377
[71] Ali M, Yameen B, Neumann R, Ensinger W, Knoll W, Azzaroni O.J.Am.Chem.Soc., 2008, 130 (48) :16351-16357
[72] Guo Z, Wang J, Ren J, Wang E.Nanoscale, 2011, 3 (9) :3767-3773
[73] Siwy Z S, Powell M R, Petrov A, Kalman E, Trautmann C, Eisenberg R S.Nano Lett., 2006, 6 (8) :1729-1734
[74] Siwy Z S, Powell M R, Kalman E, Astumian R D, Eisenberg R S.Nano Lett., 2006, 6 (3) :473-477
[75] Zhai Q, Wang J, Jiang H, Wei Q, Wang E.Talanta, 2015, 140:219-225
[76] Zhang S, Sun T, Wang J.Microchim.Acta, 2015, 182 (7-8) :1387-1393
[77] Wen L, Sun Z, Han C, Imene B, Tian D, Li H, Jiang L.Chem-Eur.J., 2013, 19 (24) :7686-7690
[78] Xie G, Tian W, Wen L, Xiao K, Zhang Z, Liu Q, Hou G, Li P, Tian Y, Jiang L.Chem.Commun., 2015, 51 (15) :3135-3138
[79] Lin L, Yan J, Li J.Anal.Chem., 2014, 86 (21) :10546-10551
[80] Ali M, Ramirez P, Tahir MN, Mafe S, Siwy Z, Neumann R, Tremel W, Ensinger W.Nanoscale, 2011, 3 (4) :1894-1903
[81] Ali M, Nasir S, Ramirez P, Cervera J, Mafe S, Ensinger W.J.Phys.Chem.C, 2013, 117 (35) :18234-18242
[82] Ali M, Nasir S, Ensinger W.Chem.Commun., 2015, 51 (16) :3454-3457
[83] Ali M, Nasir S, Nguyen Q H, Sahoo J K, Tahir M N, Tremel W, Ensinger W.J.Am.Chem.Soc., 2011, 133 (43) :17307-17314
[84] Buchsbaum S F, Nguyen G, Howorka S, Siwy Z S.J.Am.Chem.Soc., 2014, 136 (28) :9902-9905
[85] Zhang Z, Xie G, Xiao K, Kong X Y, Li P, Tian Y, Wen L, Jiang L.Adv.Mater., 2016, 28 (43) :9613-9619
[86] Xiao K, Wen L, Jiang L.Small, 2016, 12 (21) :2810-2831
[87] Jiang H, Wang E, Wang J.RSC Adv., 2015, 5 (45) :35622-35630
[88] Zhai Q, Jiang H, Zhang X, Li J, Wang E.Talanta, 2016, 149:280-284
[89] Zhai Q, Fan D, Zhang X, Li J, Wang E.NPG Asia Mater., 2017, 9 (8) :e421
[90] Zhang X, Zhai Q, Xing H, Li J, Wang E.ACS Sensors, 2017, 2 (3) :320-326
[91] Zhai Q, Zhang X, Han Y, Zhai J, Li J, Wang E.Anal.Chem., 2016, 88 (1) :945-951
[92] Gao R, Ying Y L, Hu Y X, Li J, Long Y T.Anal.Chem., 2017, 89 (14) :7382-7387
[93] Gilboa T, Meller A.Analyst, 2015, 140 (14) :4733-4747
[94] ZHANG Ming-Hui, ZHAI Jin.Prog.Chem., 2012, 24 (4) :463-470张明辉, 翟锦。化学进展, 2012, 24 (4) :463-470