
在过去几年,被称为“Sirtuin”的Sir2蛋白家族在多种模式生物中已经成为一类对衰老和长寿具有关键作用的调控因子。它们进化上高度保守,这为衰老领域研究提供了一种新模式。
SIR2基因首先由Klar在酵母中鉴定并发现其具有延长寿命、延缓衰老的功能。随后相继研究发现SIR2在线虫及果蝇中的同源基因也具有相似功能。哺乳动物中Sirtuins家族有7个成员(SIRT1~SIRT7),其中SIRT1与SIR2的同源性最高。研究发现,在热量限制或氧化逆境条件下,SIRT1蛋白主要是通过抑制PPAR-γ减少细胞的脂质过氧化的损伤,调控p53的活性及调控FOXO的信号通路启动细胞抗氧化来影响细胞的寿命,不仅如此,SIRT1蛋白还参与多种生理及病理代谢途径。
猪是人类及动物衰老和疾病研究中的重要模型,其Sirtuins家族也得到了广泛研究。
更好的研究SIRT1基因在猪体内的作用,准确测定SIRT1蛋白在各种生理及病理条件下在各组织中的活动尤为重要,SIRT1蛋白的抗体则是测定SIRT1蛋白活动的关键,笔者克隆出猪的SIRT1基因,并制备其多克隆抗体,以期为研究SIRT1蛋白提供有力保障。
1、材料与方法
1.1试验材料
试验用猪为广州良种猪场提供的杜大长健康商品猪(杜络克×大白×大长)。
pET-28a(+)载体,克隆菌株E.coli DH5α和表达菌株E.coli Rosetta(DE3)均由笔者所在实验室保存;pMD18-TVector购于宝生物工程(大连)有限公司;抗组氨酸(His)标签兔多克隆抗体、辣根过氧化酶(HRP)标记的羊抗兔IgG购自北京康为世纪生物科技有限公司;蛋白纯化柱购自Bio-rad公司,组氨酸亲和层析填料Ni-NTA购自德国QIAGEN生物公司。
1.2酶与化学试剂
DNA聚合酶KOD-FX购自日本东洋纺(TOYOBO)公司;DNA marker、限制性内切酶、蛋白质marker、RNA提取及cDNA制备试剂盒均购于宝生生物(TaKaRa)公司;琼脂糖凝胶DNA回收试剂盒、质粒提取吸附柱购自生工生物有限公司;IPTG、X-gal、氨苄青霉素(ampicilin,Amp)、卡那霉素(kanamycin,Kan)等常用生化试剂均购自翔博生物科技有限公司及鼎国生物科技有限公司。
1.3引物设计及合成
根据GenBank上发表的猪的SIRT1基因序列(GenBank:EU030283.2)设计克隆全基因表达序列的引物,上游引物S1:5′-AGAGGCAGTT-GAAAGATGGCGGACGAG-3′,下游引物S2:5′-CACCTTTCTGGTTTCCTTGCGCTACTAGGTTC-3′。选择SIRT1蛋白序列抗原表位比较集中且GC含量适中的C末端序列进行抗原制备,根据其序列及pET-28a(+)Vector的序列设计Ω-PCR插入引物,上游引物S3:5′-TGGTGCCGCGCGGCAGCCATATGAAGTATGACAAAGATGAAGTTGATC-3′,下游引物S4:5′-GTGGTGGTGGTGGTGGTGCTCGAGTGCGTTATGATTTGTTTGATGGA-3′。引物合成及基因测序由上海生工生物工程有限公司完成。
1.4目的基因的克隆
Trizol法提取猪的大脑组织RNA,使用反转录酶M-mlv,以OligoDT为引物合成猪的cDNA。以cDNA为模板,使用引物S1、S2及聚合酶KOD-FX,进行SIRT1基因的扩增,回收纯化扩增产物并与pMD18-TVector连接。将重组质粒转化,筛选阳性克隆并进行测序。
PCR的扩增条件为:94℃预变性2min;98℃10s,63℃30s,68℃2min30s,进行28个循环;68℃延伸10min,16℃低温结束。
1.5pET-28a-SIRT1表达载体的构建和鉴定
使用KOD-FX聚合酶,以鉴定正确的pMD18-T-SIRT1质粒为模板,以引物S3、S4扩增SIRT1抗原表位序列。再以扩增出来的抗原表位序列为超级引物,以pET-28a质粒为模板,使用KOD-FX聚合酶以Ω-PCR的方法将SIRT1蛋白抗原表位碱基序列插入pET-28a(+)。
Ω-PCR产物立即转入表达菌株E.coliRosetta(DE3),卡那霉素(终质量浓度为30μg/mL),氯霉素(终质量浓度为30μg/mL)PCR筛选阳性克隆送基因公司测序。
Ω-PCR扩增抗原表位条件为:94℃预变性2min;98℃10s,62.5℃30s,68℃1min20s,进行28个循环;68℃延伸10min,16℃低温结束。
Ω-PCR插入抗原表位条件为:94℃预变性2min;98℃12s,57℃30s,68℃4min20s,进行6个循环;98℃12s,68℃5min进行23个循环;68℃延伸7min,16℃低温结束。
1.6目的基因表达分析及纯化
将空载体pET-28a(+)转化E.coliRosetta(DE3)细胞,卡那霉素、氯霉素筛选单菌落。将空载体pET-28a(+)阳性克隆及测序正确的pET-28a-SIRT1阳性菌落分别划线活化后,挑取单菌落接种于含卡那霉素、氯霉素的LB培养液中,37℃振荡培养过夜。加入不同梯度浓度IPTG,分别在诱导2、3、4、5、6h时取培养菌液,煮沸裂解后以10%聚丙烯酰胺凝胶电泳进行分析,以确定最佳诱导条件。
以最优条件诱导pET-28a-SIRT1阳性菌落,离心收集菌体。收集的菌体重悬后裂解破碎,分别收集上清液及沉淀物,进行聚丙烯酰胺凝胶电泳,对融合蛋白进行可溶性分析。分析确定表达形式的样品,进行Westernblot以HIS标签鉴定目的蛋白。
样品经聚丙烯酰胺凝胶电泳后电转至PVDF膜上,封闭后依次使用抗组氨酸(His)标签兔多克隆抗体及辣根过氧化酶(HRP)标记的羊抗兔IgG进行孵育,后使用增强型HRP-DAB显色剂进行显色,携带His标签的蛋白可看出明显颜色。
以最优条件大量诱导pET-28a-SIRT1阳性菌落,离心收集菌体,经洗涤缓冲液洗涤后,置破碎液中冰浴、超声裂解菌体,直至溶液不再粘稠,离心取上清液用0.45μm滤膜过滤。然后目的蛋白经过镍柱进行纯化和收集,将样品经10%聚丙烯酰胺凝胶电泳切取目的条带,将含有目的条带的胶条置于透析袋中通过低温电泳回收蛋白溶液。将蛋白溶液超滤浓缩后,再次进行Westernblot鉴定纯化出的蛋白是否带His标签。
1.7SIRT1兔多克隆抗体制备
纯化出的蛋白经定量后分4次免疫健康新西兰大白兔,第1次免疫使用完全弗氏佐剂,后3次使用不完全弗氏佐剂,每次免疫量为100μg蛋白,背腹部皮下注射,免疫间隔为1~2周。每次免疫前后均抽取耳沿静脉血3mL,4℃静置过夜后,离心保留血清。第3次免疫后以抗原包被,ELISA鉴定血清效价,抗体滴度达到212即可,若没达到则补充免疫达到目标滴度后取兔全血血清,ELISA鉴定后即可于-80℃条件下保存。
2、结果与分析
2.1SIRT1基因的PCR扩增与pET-28a-SIRT1表达载体的构建
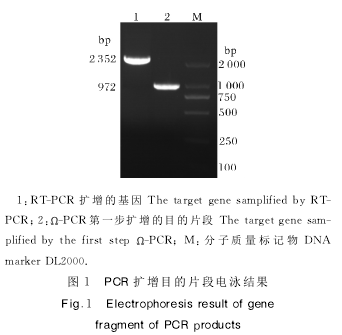
SIRT1基因RT-PCR扩增产物经1%琼脂糖凝胶电泳,使用DL2000DNAmarker作为对照,约在2353bp处出现1条清晰条带,与预期片段大小相近,连接克隆载体后经双酶切大小正确,生物测序序列正确,表明已获得SIRT1基因。
Ω-PCR第1轮扩增产物经1%琼脂糖凝胶电泳,使用DL2000DNAmarker作为对照,约在972bp处出现1条清晰条带,与设计片段大小一致,表明得到设计序列,第2轮Ω-PCR筛选出阳性质粒,由生工生物工程有限公司测序证实结果正确,表明成功构建表达质粒。PCR扩增产物电泳结果如图1所示,表达质粒测序结果如图2所示。
2.2目的基因的诱导表达及重组蛋白鉴定表达形式的分析
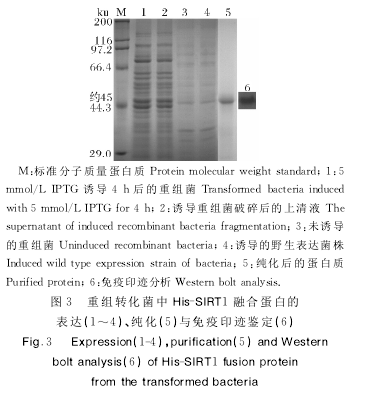
将表达质粒pET-28a-SIRT1转入大肠杆菌Rosetta(DE3)中进行诱导表达,优化诱导IPTG浓度、诱导温度及诱导时间,然后进行电泳分析。结果发现,经5mmol/LIPTG诱导4h的菌株在预测的分子质量45ku位置出现最显著表达量差异,超声波破碎后离心定位分析表明,此差异在破碎液上清中比较明显,并且此差异条带经免疫印迹(Western blot)检测表明携带HIS标签,故确定此融合蛋白即为插入SIRT1基因的目的片段所表达。经纯化,得到预期大小、条带单一的纯净蛋白质样品。重组转化菌中His-SIRT1融合蛋白的表达分析、纯化与免疫印迹鉴定结果如图3所示。
2.3SIRT1兔多克隆抗体制备结果
第3次免疫之后,ELISA检测结果显示兔血清对试验中纯化的SIRT1蛋白抗体滴度已达到28,如图4A,加强免疫后,抗体滴度达到212,如图4B,符合多克隆抗体使用要求,即取全血,保存血清。此血清与猪肌肉及大脑总蛋白进行ELISA及免疫印迹分析,ELISA结果如图4C、D,表明此多克隆抗体效价符合试验预期。


3、讨论
目前,SIRT1基因已较广泛应用于细胞的生存、衰老、凋亡等研究中,并在猪及人的器官衰老方面具有潜在的应用价值,李碧霞等建立了猪SIRT1基因荧光定量的检测方法。本研究的积极意义就是制备了猪的SIRT1蛋白多克隆抗体。只有很少的商业抗体能够和猪的SIRT1蛋白相互反应,但是它们的活性和特异性并不充分,因此我们打算制备专门对猪的SIRT1多克隆抗体。为此,猪的SIRT1蛋白抗原表位被异源表达并且被高度纯化。
本试验中由新西兰大白兔产生的抗体能够特异地识别猪的SIRT1蛋白,通过ELISA及免疫印迹分析,表明它可以很特异地识别猪的SIRT1蛋白。也就是说,这个多克隆蛋白不仅能够特异性地识别重组表达的SIRT1抗原表位序列,也能够特异性地识别猪体内完整的SIRT1蛋白。
研究中选择的SIRT1蛋白抗原表位蛋白质分子质量大小应为35.3ku,然而试验中表达出来的蛋白质分子质量大小约为45ku,这可能和蛋白质在大肠杆菌中的修饰过程有关。总的来说,我们使用重组SIRT1蛋白作为免疫原制备了猪的SIRT1的多克隆抗体,这个多克隆抗体能够高效特异识别猪的P53蛋白,不管这种蛋白是变性的还是非变性的。
总之,我们扩增得到猪的SIRT1基因并且通过外源表达SIRT1蛋白的抗原表位来免疫新西兰大白兔,从而获得能够特异性地识别猪的SIRT1蛋白多克隆抗体。借此,猪各个器官在生理和病理状况下其SIRT1蛋白的活动水平就可以很容易地被研究,这个抗体也可以成为以猪为模型来研究人类疾病中SIRT1通路的一个有力工具。





