
近年来新疆实验动物研究中心一直致力于灰仓鼠( Cricetulus migratorius) 等野生啮齿类动物的实验动物化研究,结果表明灰仓鼠在鼠疫菌分离,包虫病动物模型等方面明显优于现有其他实验动物,具有良好的应用前景[1].在对目前驯化饲养的灰仓鼠进行体内寄生虫调查时,发现其体内普遍感染鞭毛虫( Tritrichomonas sp) .实验动物国家标准《实验动物 寄生虫学等级及监测》( GB 14922. 1-2001) 规定:SPF 级实验动物体内不得携带鞭毛虫及纤毛虫[2].
该种鞭毛虫的存在影响灰仓鼠作为一种新型实验动物,SPF 级种群的建立.明确此次分离到的鞭毛虫生物学种属,才能采取有效的手段对现有灰仓鼠进行生物净化,提高该品种实验动物质量.本研究利用形态学及分子生物学方法对该鞭毛虫的种属进行鉴定,为今后对灰仓鼠进行生物净化及制定灰仓鼠寄生虫检测等级标准提供参考依据.
1 材料与方法
1. 1 鞭毛虫的分离
鞭毛虫虫株分离自新疆实验动物研究中心驯化饲养的普通级灰仓鼠【SCXK( 新) 2011-0002】回盲部,实验动物相关实验在新疆实验动物研究中心动物实验基地【SYXK( 新) 2011-0003】进行.
1. 2 实验设备和主要试剂
光学显微镜( HSZ-H) ; PCR 仪( BIO-RAD) ; 凝胶成像系统( BIO-RAD) ; 瑞氏-姬姆萨染液; 柱式DNA 提取试剂盒 ( 天根生化科技 ( 北京) 有限公司) .
1. 3 方法
1. 3. 1 直接涂片法观察
二氧化碳麻醉过量处死灰仓鼠,打开腹腔解剖回盲部,挑取适量内容物置于载玻片,滴加适量生理盐水稀释,置于光学显微镜( ×400) 下观察.
1. 3. 2 瑞氏-姬姆萨染色法观察
将稀释 100 倍的混悬液涂片,自然干片后加入瑞氏-姬姆萨染液试剂盒中 A 液染色 2 min 后,加入2 倍体积 B 液染色 5 min,清水冲洗后光学显微镜下观察.
1. 3. 3 鼠三毛滴虫( Tritrichomonas sp) 16s rRNA 基因的扩增与序列分析
根据 Cepicka I 已发表的鼠三毛滴虫 16 SrRNA基因序列设计引物: 上游引物 P1: 5'-ACTTCTGT-TCGTTCACTGT-3'; 下游引物 P2: 5'-CCTTCCGTCAAT-TCCTTCA-3'( 引物由上海生工生物有限公司设计并合成) .柱式 DNA 提取试剂盒提取虫体总 DNA.
PCR 反应体系( 25 μL) 为: PCR master 12. 5 μL,上、下游引物各0. 75 μL,基因组模板 2 μL,H2O 9 μL.扩增条件:94℃ 5 min;94℃ 30 s,54℃ 30 s,72℃ 1 min,30 个循环; 72℃10 min.将 PCR 产物以 2% 的琼脂糖凝胶电泳检测片段大小.将 PCR 产物冰冻包装邮寄至北京博迈德科技发展有限公司测序.
登陆 NCBI BLAST 进行核酸同源性比较,应用MEGA5. 22 软件将测得序列与已报道的三毛滴虫 16SrRNA 基因进行对比分析并绘制系统发育进化树.
2 结果
2. 1 形态观察
用光学显微镜 400 倍观察灰仓鼠回盲部内容物涂片 ,镜下可见大量水滴形、梨形以转圈方式游动的虫体,虫体游动活泼.光学显微镜 1000 倍观察可见由前向后呈波浪状运动的波动膜 .以戊二醛固定虫体后进行瑞氏-姬姆萨染色 ,置于光学显微镜 1000 倍可见虫体生出 3 根前鞭毛,测量虫体长度平均为 18 μm,宽度平均为 10 μm .( 图1 ~ 3 见彩插 8略)
2. 2 基因测序结果与序列分析
应用所设计的引物体外扩增 Tritrichomonasmuris 的部分 16S rRNA,扩增出的片段约为 378 bp( 见图 4) ,与预期的扩增片段相符.

部分 16S rRNA 基因的测序结果:
ACTCAGCGCA GTATGATATC TTTACTTCTAGTAAAATCAA TGAGAGCCAC 50
CGGGGGTAGA TCTATTTCAT GGCGAACGGTGGAATGTTTT GACCCATGAG 100
AGAGAAACGA AGGCGAAAGC ATCTACCTAGAGGGTTTCTG TCGATCAAGG 150
GCGAGAGTAG GAGTATCCAA CCGGATCAGAGACCCGGGTA GTTCCTACCT 200
TAAACGATGC CGACAGGGGC TTGTCCTTTCATGAGGGCAG GACCTTAGGA 250
GAAATCATAG TTCTTGGGCT CTGGGGGAACTACGACCGCA AGGCTGAAAC 300
TTGAAGGATT TGA 313
以上基因序列通过 NCBI BLAST 进行核酸同源性比较,结果与已报道的鼠三毛滴虫( T. muris)( AY886846. 1) 的核酸序列具有高度同源性,同源性为 99%.
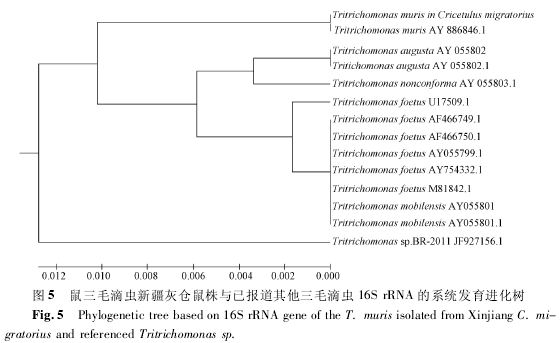
测得序列使用 MEGA5. 2 软件与已报道的相关三毛滴虫 16S rRNA 基因对比分析绘制系统发育进化树( 图 5) ,结果表明灰仓鼠体内鼠三毛滴虫 16SrRNA 基因与已报道的鼠三毛滴虫16S rRNA( AY886846. 1) 位于同一进化分支,与其他相关三毛滴虫亲缘关系较远.
3 讨论
鼠三毛滴虫是一种常见于开放环境饲养的实验大、小鼠和野生啮齿类动物回盲部的非致病原虫类寄生虫[3].研究表明三毛滴虫主要通过被粪便或饮水经口感染[4].近年来国内外文献对鼠三毛滴虫鲜有报道,原因主要有: ①实验动物质量普遍提高,实验动物国家标准早已淘汰普通级大小鼠.②鼠三毛滴虫为非致病原虫,对宿主危害性小于其他三毛滴虫,如: 牛胎儿三毛滴虫( T. foetus) 和猪三毛滴虫( T. suis)[5].此次灰仓鼠体内分离到的鞭毛虫通过形态学观察对应参照《实验大鼠、小鼠肠道鞭毛虫检索表》[6],虫体呈梨形,有 3 根前鞭毛,轴柱与体表接触处有着色环,轴柱在体外部分变得尖细,波动膜和肋发育良好,属于三毛滴虫属; 此外通过对该鞭毛虫寄生部位、运动形式及大小等方面的系统分析初步确定该鞭毛虫为鼠三毛滴虫.该虫株16S rRNA 测序结果与已报道的其他三毛滴虫 ( 除T. muris ( AY886846. 1) 外) 亲缘关系均较远,提示鼠三毛滴虫可能具备一些自身特点,有待今后进一步研究.
参 考 文 献
[1] Liao LF. Study of grey hamster Cricetulus migratorius as an ex-perimental animal [J]. Chin J Lab Anim Sci. 2002,12: 183 -185.
[2] 国家技术监督局. 实验动物寄生虫学等级及监测 [S]. GB14922. 1 - 2001.
[3] 陈德威. 啮齿类实验动物疾病学[M]. 北京: 北京农业大学出版社,1993.
[4] 王钜,王晓辉,卢静. 普通环境和清洁级环境中长爪沙鼠寄生虫感染状况观察[J]. 中国比较医学杂志,2004,14( 3) :132 - 134.
[5] 李建华,韩红卫,宫鹏涛. 猪三毛滴虫长春株的形态观察及其 5. 8S rRNA 基因分析[J]. 中国兽医科学,2010,40( 02) :121 - 124.
[6] 高诚,符杰,王胜昌. 实验大鼠、实验小鼠肠道鞭毛虫种类和检索[J]. 中国兽医寄生虫病,2000,8( 2) : 9 -11.





