摘 要: 以青岛水族馆7只麦哲伦企鹅的新鲜血液为对象提取基因组DNA,根据基因组数据设计性别特异引物P2/P8,对其CHD基因进行PCR扩增,回收扩增的目的片段进行测序,获得这些麦哲伦企鹅的性别相关基因序列。将这7只麦哲伦企鹅的CHD基因序列与GenB ank上公布的短趾雕的CHD基因序列进行同源性比对分析,建立遗传进化树,初步确定编号为1572、1573、1574、1575、36的麦哲伦企鹅鉴定为雄性,编号29和1577号麦哲伦企鹅为雌性。研究表明,雌雄麦哲伦企鹅CHD基因的内含子基因序列存在差异,P2/P8引物可扩增该保守序列,基于CHD基因建立的分子生物学方法可以较好地对麦哲伦企鹅实现性别的鉴定。
关键词: CHD基因; 麦哲伦企鹅; 性别鉴定;
Abstract: We studied the sex determination of Magellanic penguin( Spheniscus magellanicus) using seven birds at Qingdao Aquarium. We extracted genome DNA from fresh blood,and amplified the CHD gene using the PCR method with the primer-pair P2/P8 specially designed based on the genome sequences. We obtained the gender-related gene sequences of these Magellanic penguins after sequencing of the purified amplicons. We compared the homology between the CHD gene sequences of the 7 Magellanic penguins and the those of Circaetus gallicus published by GenB ank,and constructed a genetic evolutionary tree based on the CHD gene sequences of the two species.We determined that Magellanic penguins #1572,#1573,#1574,#1575,and #36 were males,and #29 and #1577 were females. This study showed that there were differences in the intron sequence of the CHD gene between male and female Magellan penguins,and primer-pair P2/P8 could amplify the conserved sequences. The molecular biological method based on the CHD gene proved effective in determining the gender of Magellan penguins.
Keyword: CHD gene; Spheniscus magellanicus; Sex determination;
企鹅,属于鸟纲(Aves),是企鹅目(Sphenisciformes)中所有鸟类的通称,目前已知共有6属18种。麦哲伦企鹅(Spheniscus magellanicus)又称为麦氏环企鹅,是温带企鹅中最大的物种,主要分布在南美洲秘鲁、阿根廷、智利等,主要的外形特征是有一条白色的宽带从眼后过耳朵一直延伸至下颌附近,一般身高约70 cm,体重约4 kg[1]。麦哲伦企鹅属群居性动物,与非洲企鹅(Spheniscus demersus)及洪氏环企鹅(Penguin humboldt)亲缘关系近。麦哲伦企鹅是一种单态性鸟类,无论是幼体还是成体都很难从外观或行为上进行性别鉴定,所以给人工繁殖造成了很大的困难。为了提高本馆饲养的麦哲伦企鹅的人工繁殖率,采取一定的措施对其进行性别鉴定是必要的。鸟类的性别由性染色体决定,其CHD基因就位于性染色体上[2],雄性为ZZ型,雌性为ZW型。传统的鸟类性别鉴定方法有形态学、细胞生物学以及分子生物学。分子生物学是在分子水平上研究生命现象的科学,PCR扩增技术是分子生物学方法之一,是近些年发展起来的用来鉴定单态性鸟类性别的一种比较简单快速的方法。CHD基因在非平胸鸟类中有两个同源性拷贝,为CHD-W和CHD-Z[3],CHD基因非常保守,已经被广泛应用于非平胸鸟类如雁形目(Anseriformes)、鸡形目(Galliformes)、雀形目(Passeriformes)等的性别鉴定中,但在企鹅目中的应用较少。

为了进一步研究不同性别麦哲伦企鹅的行为差异性和提高馆养麦哲伦企鹅的繁殖率,本研究对青岛水族馆的编号分别为29、36、1572、1573、1574、1575、1577的麦哲伦企鹅进行了采血,基于CHD基因测序法对这7只麦哲伦企鹅进行了性别鉴定,为麦哲伦企鹅的人工繁殖奠定了基础。
1、 材料与方法
1.1、 材料
血液样本取自青岛水族馆的7只麦哲伦企鹅,编号分别为29、36、1572、1573、1574、1575、1577号,样本放置-20℃冰箱短时间保存。
1.2 、试验方法
1.2.1 、血液基因组DNA的提取
采用苯酚/氯仿抽提法进行麦哲伦企鹅的血液基因组DNA的提取,操作步骤如下:将冻存的血液于室温下解冻,转入离心管中,加入1 m L PBS混匀,3 500 rpm离心15 min,弃掉上清液。重复1次。向白细胞沉淀中加入0.7 m L DNA提取液,37℃水浴1 h。加入1 mg/m L蛋白酶K 0.2 m L,至终浓度为100—200μg/m L,上下转动混匀后50℃水浴3 h。反应液冷却至室温后,加入等体积的饱和酚溶液,温和地上下转动离心管5—10 min,直至水相与酚相混匀成乳状液。5 000 rpm离心15 min,用大口吸管小心吸取上层黏稠水相移至另一离心管中。重复酚抽提1次。加等体积的氯仿:异戊醇(24∶1)上下转动混匀。5 000 rpm离心15 min,用大口吸管小心吸取上层黏稠水相移至另一离心管中。重复1次。加入1/5体积的3 mol/L Na Ac及2倍体积的预冷的无水乙醇,室温下慢慢摇动离心管,即有乳白色云絮状DNA出现。用玻璃棒小心挑取云絮状的DNA转入新的1.5 m L离心管中,加70%乙醇0.2 m L,以5 000 rpm离心5 min。洗涤DNA弃上清,去除残留的盐。重复1次。置于室温下挥发残留的乙醇,但不要让DNA完全干燥。最后加TE液20μL溶解DNA,置于摇床平台缓慢摇动。DNA完全溶解通常需12—24 h。制成的DNA液-20℃保存备用。
1.2.2、 PCR反应
以提取的基因组DNA为模板,利用引物P2/P8,引物P2:5'-TCTGCATCGCTAAATCCTTT-3',引物P8:5'-CTCCCAAGGATGAGRAAYTG-3',对7只麦哲伦企鹅的CHD基因进行扩增。反应体系为25μL,PCR扩增条件为:94℃5 min;94℃30 s,56℃30 s,72℃1 min,进行32个循环;72℃10 min。PCR反应在PCR仪上进行,PCR产物置于4℃保存。
1.2.3 、PCR产物克隆、测序及比对分析
按照OMEGA胶回收试剂盒说明书步骤进行操作,将PCR产物进行胶回收,置于-20℃冰箱保存备用。将PCR产物连接至T载体,然后转至感受态细胞DH5a进行克隆,并将克隆后的菌液4℃分管保存,送去上海生工进行测序,然后将测序结果与NC-BI上公布的短趾鹰(Circaetus gallicus)的CHD基因序列进行Bl AST序列比对分析,通过基因进化树来鉴定7只麦哲伦企鹅的性别。
2 、结果
2.1、 基因组的提取浓度与纯度
利用试剂盒提取麦哲伦企鹅基因组DNA,用分光光度计检测其浓度和纯度。结果显示,提取DNA的平均浓度在400 ng/μL左右;OD260/OD280在1.8—2.0,OD260/OD230在2.0—2.5,所提取的DNA纯度较好,可用于后续的实验。
2.2 、麦哲伦企鹅CHD基因片段的扩增结果
利用引物P2/P8对7只麦哲伦企鹅的CHD基因片段进行了扩增,取5μL PCR产物进行1%琼脂糖凝胶电泳,结果见图1。从图1的凝胶电泳图发现,扩增的目的条带大小约380 bp。从图1中只能看出1条带,而且片段大小差别不大,所以很难从琼脂糖凝胶电泳条带中将麦哲伦企鹅的雌雄区别开来。
2.3、 PCR产物的测序结果及与短趾鹰Blast比对分析
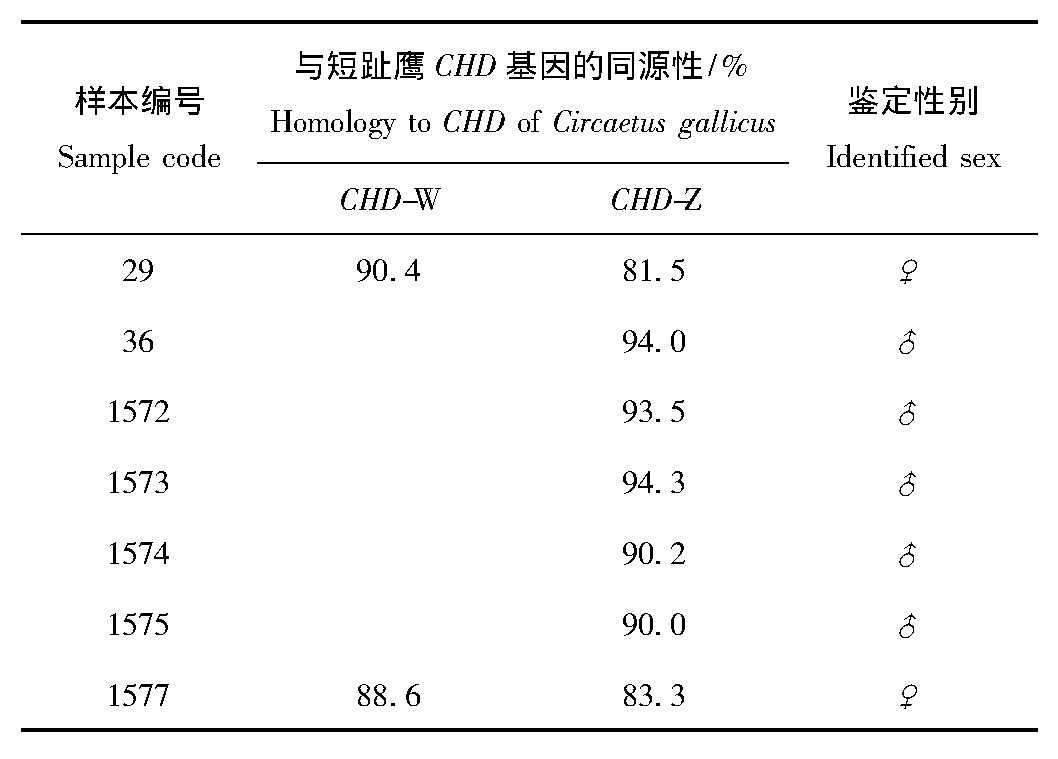
将PCR产物连接至T载体,然后转至感受态细胞DH5a进行克隆,每只企鹅样本分别挑选7个克隆,然后送去上海生工进行测序。将测序结果与Gen Bank中公布的短趾鹰的CHD基因序列进行Blast比对和同源性分析。对Blast结果进行分析,出现CHD-W,则可判定企鹅个体为雌性(ZW型),若仅出现CHD-Z,则可判定该个体为雄性(ZZ型)。从表1中可以看出,编号为36、1572、1573、1574、1575号的麦哲伦企鹅为雄性。编号29与1577号的企鹅个体为雌性。
图1 PCR扩增产物电泳图谱
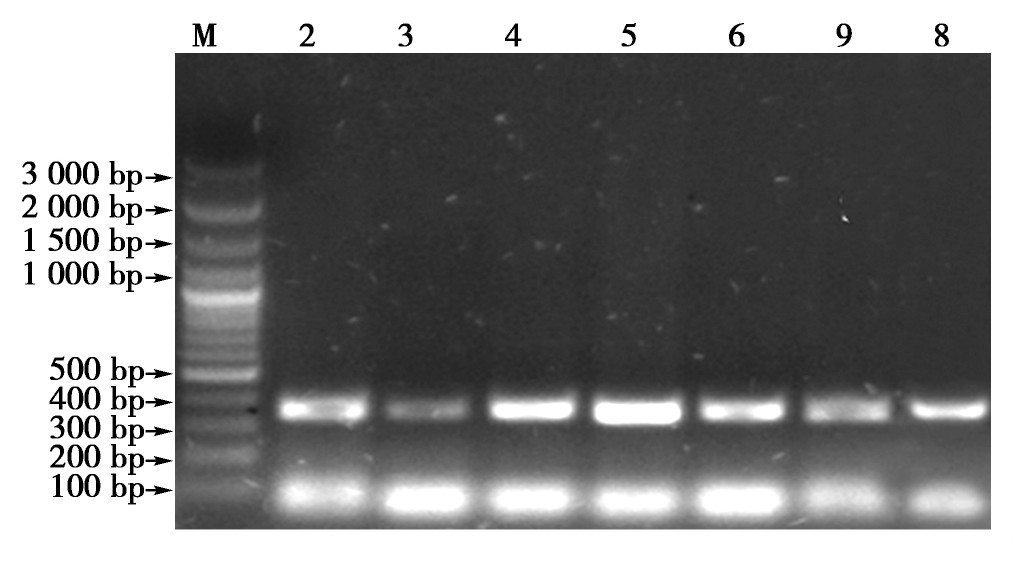
Fig.1 Electrophoresis of PCR amplification products
注:M:DNA Maker3000;2:1572号样本;3:1573号样本;4:1574号样本;5:1575号样本;6:36号样本;9:29号样本;8:1577号样本
Note:M,DNA Maker3000.2,No.1572 sample.3,No.1573sample.4,No.1574 sample.5,No.1575 sample.6,No.36sample.9,No.29 sample.8,No.1577 sample
表1 7只麦哲伦企鹅CHD基因序列比对与性别鉴定结果
3 、讨论
鸟类的羽毛、血液、肌肉以及胚胎的尿囊液都可以提取基因组DNA。微量血PCR、血液、羽毛、肌肉和鸡胚组织等材料提取DNA后的PCR方法均可准确快速鉴定鸡和鸡胚的性别[4]。新生鸟类翅静脉和颈静脉小,采血困难,通过心脏采血法可以采集到足够的血液,但采血方法对动物的伤害极大。羽毛的再生能力强,可以通过非伤害性采样获得,动物的应激和伤害较小,适合规模化鉴定。本试验采用7只企鹅的年龄与编号:29、36号企鹅为11岁左右,1572、1573、1574、1575与1577号企鹅为7岁左右,人工采血前期对这7只企鹅进行了人工保定与采血的脱敏训练,减少采血的应激性,并在企鹅状态非常好的情况下在企鹅的翼下静脉进行了采血,将获得的新鲜血液立即置于-20℃冰箱保存或用于试验。
提前鉴定动物性别,不仅能够为饲养提供合理指导,提高经济价值,也能满足科研领域区分性别的需求,提前规划珍稀动物的繁育。董忠典等[5]通过对弓背青鳉(Oryzias curvinotus)基因组数据分析、性别特异引物设计、DNA提取、PCR扩增,利用琼脂糖凝胶电泳在雌性弓背青鳉基因组DNA中可扩增出单一条带,在雄性基因组DNA中可扩增出双条带,从而快速、准确鉴定弓背青鳉遗传性别。
全世界绝大部分鸟类是单态性,即雌雄同型,它们的个体无论是处在幼体还是成体时期,都很难从外观上和行为上将其区分开来,因此性别早期鉴定对鸟类的人工饲养管理、繁育、疾病防治等方面存在重要的意义。目前鸟类的性别鉴定方法有很多,其中传统的方法主要有目测性器官或对性腺进行直接造影的内窥镜及超声波检查等形态学方法[6],其精确度不高。后来发展了染色体组型方法[7]和激素分析法[8]。分子生物学方法是近年来发展起来的一种利用PCR扩增技术来对鸟类进行性别鉴定的一种新的方法。鸟类的基因型为ZW型,雄性为ZZ型,雌性为ZW型。染色体螺旋蛋白基因(chromo-helicase-DNA-binding gene,CHD基因)是性染色体上编码调节转录活性蛋白的一个功能性基因,在非平胸鸟类有两个同源性拷贝,即CHD-W和CHD-Z。由于雌性基因型为ZW,因此其扩增电泳图出现2条带,雄性基因型为ZZ,则扩增电泳图仅能扩增出1条带[9]。徐丽晶等[10]合成了通用引物g CHD,PCR扩增产物经琼脂糖电泳分析后,准确鉴定了85只SPF金定鸭(Anas platyrhynchos)的性别。江彬等[11]利用引物P2和P8从鹭类Z染色体上扩增出380 bp和390 bp 2条长度不同的片段,从W染色体上扩增出380 bp 1条片段,用于性别鉴定。
自1995年CHD基因被应用于鸟类性别的分子鉴定以来,平胸鸟类性别鉴定问题正逐步被解决,CHD基因已经成为非平胸鸟类性别鉴定最重要的分子标记[12]。后来研究发现CHD基因并不是鸟类性别的决定性基因,但该基因在鸟类性别的分子鉴定方面发挥着巨大的作用。沈玮等[13]对PCR产物进一步进行CHD基因序列分析,采用Blast序列比对分析,依据CHD-Z或CHD-W基因的同源性鉴定出帝企鹅(Aptenodytes forsteri)的性别。本研究利用PCR扩增与同源性比对分析相结合的方法来对麦哲伦企鹅进行性别鉴定。选用引物P2/P8扩增出了麦哲伦企鹅的CHD基因,对扩增后的PCR产物进行CHD基因序列的Blast比对与同源性分析,成功鉴定了麦哲伦企鹅的性别。与其他鸟类性别鉴定方法相比,该方法采用PCR方法,利用稳定遗传的基因组DNA,解决了两者基因大小差别不大造成难以准确判定的困难,从而不依赖于较难区别的外部形态,结果更可靠,而且对于刚出生的企鹅也同样适用,这种方法可以实现对性别的早期鉴定,而且操作简便,周期短,可以同时检测大量的样品,是到目前为止最为简单快捷、准确可靠的鸟类性别鉴定的途径。
近年来,由于环境污染,植被破坏等因素导致许多珍稀野生鸟类濒临灭绝。为了更好地保护鸟类,必须采取一定的措施来提高它们的繁殖率,所以对这些珍稀野生鸟类进行人工繁育和迁地保护将发挥非常重要的作用。全世界鸟类中绝大部分鸟类是单态性鸟类,即雌雄同型,它们的个体无论是处在幼体还是成体时期,都很难从外观上和行为上将其区分开来,所以鸟类的性别早期鉴定对鸟类的人工饲养管理、繁育、疾病防治等方面存在重要的意义。本研究建立的基于CHD基因的分子生物学方法能够较为准确快速地鉴定出麦哲伦企鹅的性别,对提高馆养麦哲伦企鹅的人工繁殖率和饲养管理水平,以及进一步研究保护濒危野生鸟类具有重要的意义。
参考文献
[1] 苏琳荣,王建明,刘唐美.麦哲伦企鹅霉菌病初探[J].兽医导刊,2015(2):124-125.
[2] 刘铸,白素英,田秀华.CHD基因与非平胸鸟类性别鉴定[J].生物技术通报,2006(增刊1):147-150.
[3] GRIFFITHS R,KORN R M.A CHD1 gene is Z chromosome linked in the chicken Gallus domesticus[J].Gene,1997,197(1/2):225-229.
[4] 孙嘉,杨树青,孙珂,等.采用血液、羽毛等材料鉴别鸡性别PCR方法的应用研究[J].家禽科学,2016(7):11-15.
[5] 董忠典,龙水生,黄承勤,等.一种快速鉴定弓背青鳉遗传性别的方法[J].广东海洋大学学报,2018,38(3):25-29.
[6] 包文斌,胡飞,徐琪,等.鸟类性别鉴定的分子生物学方法[J].中国畜牧兽医,2007,34(10):33-36.
[7] ARGARINI A D,NUGROHO H A,PURWANINGRUM M,et al.Molecular bird sexing on fischeri lovebird(Agapornis fischeri)by using polymerase chain reaction[J].BIO Web of Conferences,2020,20:04003.
[8] HILDEBRANDT T,PITRA C,S?MMER P,et al.Sex identification in birds of prey by ultrasonography[J].Journal of Zoo and Wildlife Medicine,1995,26(3):367-376.
[9] GRIFFITHS R,DOUBLE M C,ORR K,et al.A DNA test to sex most birds[J].Molecular Ecology,1998,7(8):1071-1075.
[10] 徐丽晶,孙畅,陆涛峰,等.应用PCR方法快速鉴定SPF金定鸭性别[J].实验动物与比较医学,2017,37(3):249-251.
[11] 江杉,陈小麟.扩增性别基因片段的鹭类性别鉴定方法的研究[J].厦门大学学报(自然科学版),2006,45(增刊1):152-155.
[12] 刘清神,董泽敏,刘子呢,等.保护珍稀鸟类的无损伤采样和性别分子鉴定[J].养禽与禽病防治,2008(8):32-33.
[13] 沈玮,潘少坤,罗红梅,等.基于CHD基因序列分析的帝企鹅性别鉴定研究[J].安徽农业科学,2010,38(3):1167-1168;1214.





