铅是严重危害危害人类健康的一种重金属元素,铅暴露对人体各组织均有毒害作用,特别是免疫毒性[1].研究发现,铅暴露可导致免疫细胞数目锐减、生理活性及增殖能力降低,相关免疫蛋白合成速度降低,机体免疫功能受损[2-6].钙作为机体所需的常量元素,有研究表明摄入适量钙可干预铅对机体的免疫损伤[7-9],但是从细胞和分子角度调控机制不明确。本研究通过建立动物试验模型,从细胞和分子角度研究不同剂量钙对染铅大鼠免疫损伤的干预作用,从而为进一步阐明钙排铅的作用机制提供理论依据。
1 材 料 与 方 法
1.1 材料
1.1.1 试验动物:雄性 SD 大鼠(出生 21 d,刚断乳幼鼠),平均体质量(50±5)g,共 60 只(北京维通利华公司)。
1.1.2 主要试剂:Trizol 试剂、兔抗鼠 Ig G 血清、大鼠 Ig G 标准品、血清 Ig G 试剂盒、总 RNA 提取试剂盒、Prime ScriptTMRT Master Mix 反转录试剂盒、SYBR Premix Ex TaqTMⅡ荧光定量试剂盒(南京建成)。其它试剂均为国产分析纯。
1.1.3 主要仪器:D-3752 高速冷冻离心机[德国赛唯斯科技(Sigma)],DNM-9606 酶标分析仪(北京普朗新技术),HY-BM1160 分体式石蜡包埋机(武汉汉谷医疗科技生物),Mx3000P 实时荧光定 量 PCR 仪[美 国 安 捷 伦 ( Stratagene)],Eppendorf AG 核 酸 蛋 白 检 测 仪 [ 德 国 艾 本 德(Eppendorf)].
1.2 动物分组、饲养及样品采集
将 60 只 21 日龄雄性 SD 大鼠适应性喂养约 7d 后,按体质量随机分成五组:对照组(去离子水+基础饲料);染铅组(0.2%醋酸铅饮用水+基础饲料);试验Ⅰ组(0.2%醋酸铅饮用水+基础饲料添加 0.5%碳酸钙);试验Ⅱ组(0.2%醋酸铅饮用水+基础饲料添加 1.0%碳酸钙);试验Ⅲ组(0.2%醋酸铅饮用水+基础饲料添加 2.0%碳酸钙)。基础饲料(山西医科大学动物中心提供)中钙含量 4 g/kg,铅 0.02 mg/kg.
所有试验动物均自由摄食和饮水,连续饲养60 d.喂养结束后,摘除眼球采集全血,一部分用于血细胞计数,一部分室温下倾斜静置半小时,4 ℃、2000 r/min 离心 10 min,得血清,冷藏备用;断颈椎处死动物,取脾脏并称重记录用以计算脏器指数;一部分脾脏样品迅速在液氮中冷冻后转移至于-80 ℃冰箱中保存,用于荧光定量 PCR 检测分析;另一部分保存于 40 g/L 多聚甲醛中固定,做切片备用。
1.3 脏器指数
脏器指数=脏器重(mg)/体重(g)
1.4 细胞计数
白细胞总数计数、白细胞分类计数、T 淋巴细胞计数方法参照文献[10].
1.5 大鼠血清中 Ig G 含量测定
按试剂盒说明进行测定。
1.6 脾脏切片制作及观察
采集的脾脏组织固定 24 h 后,制备石蜡切片并进行常规 HE 染色,于显微镜下观察。
1.7 Real-time RT-PCR 法检测脾脏中 TNF-α、IL-1β、IL-6 m RNA 的相对表达量
1.7.1 大鼠脾脏组织总 RNA 的提取及反转录:提取方法参照总 RNA 提取试剂盒,得到的 RNA 进行纯度分析之后参照试剂盒步骤进行反转录,c DNA于-80 ℃下保藏。
1.7.2 引物设计:在 Gen Bank 中找到大鼠脾脏β-actin、TNF-α、IL-1β 和 IL-6 的基因序列,通过 Primer5.0 plμs 软件设计试验所需引物,TNF-α 上游引物 5'-ATGTGGAACTGGCAGAGGAG-3',下游引物 5'-CGAGCAGGAATGAGAAGAGG-3',产物大小 150bp;IL-1β 上游引物 5'-TGTTTGAG-CAGCAAGGACAC-3',下游引物 5'-ACTAGGCGTAC-ATGGCAACC-3',产物大小 138bp;IL-6 上游引物 5'-AGGAAAGGAAGGGATCAAGG-3',下游引物5'-CAGCCTTAGCATGAGGGTTC-3' , 产 物 大 小96bp;β-actin 上游引物 5'-AGCCACCAATCCACA-CAGAG-3',下游引物 5'-TACCCAGGCATTGCTGAC-AG-3',产物大小 104bp.
1.7.3 RT-PCR 反应条件:95 ℃ 10 min;95 ℃ 15s,60℃ 36 s,45 个循环;72℃ 30 s,72℃ 1 min;95℃ 15 s,60℃ 1min,95℃ 15 s.产物保存于 4℃冰箱。
1.7.4 标准曲线的制作:取样品 c DNA 1μl 为模版,2 倍浓度梯度稀释,进行进行荧光定量 PCR反应。扩增结束后,MXPro-MX3000P 软件自动分析数据并绘制标准曲线。
1.7.5 数据收集处理和分析:软件自动收集数据并计算内参基因和目的基因的 Ct 值,然后利用公式相对表达量=(待测样品目的基因起始浓度/待测样品内参基因起始浓度)/(对照样品目的基因起始浓度/对照样品内参基因起始浓度),计算目的基因的相对表达量。
1.8 数据统计与分析
全部数据采用 Graphpad Prism 5 软件进行处理,以 x ±s表示,并进行 t 检验,检验结果显示,若P<0.05,表示差异显着,若P<0.01,表示差异极其显着。
2 结 果
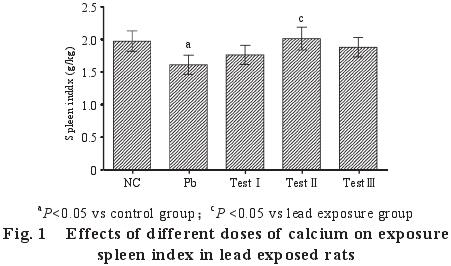
2.1 不同剂量的钙对染铅大鼠脾脏指数的影响(图 1)
与对照组对照组比较,染铅组脾脏指数下降明显,差异显着(P<0.05);与染铅组比较,试验组大鼠脾脏指数均有所升高,试验Ⅱ组升高明显,差异显着(P<0.05)。
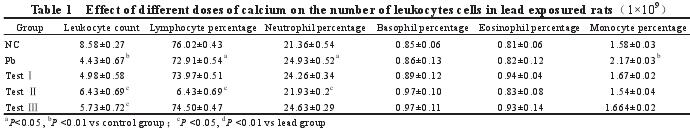
2.2 不同剂量的钙对染铅大鼠白细胞数量的影响(表 1)
与对照组比较,染铅组白细胞总数明显下降,单核细胞百分比上升,差异均达极显着水平(P<0.01);淋巴细胞百分比下降,嗜中细胞百分比升高,差异均达显着高水平(P<0.05);嗜碱性细胞和嗜酸性细胞百分比略有升高,差异均不显着。与染铅组比较,试验Ⅱ组白细胞数明显上升,嗜中性细胞下降明显,差异均达显着水平(P<0.05);试验Ⅲ组的白细胞总数明显上升,差异达显着水平(P<0.05)。
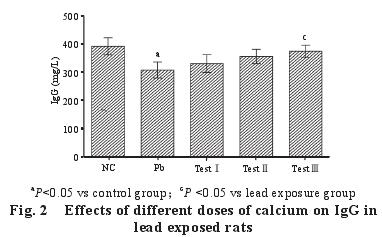
2.3 不同剂量的钙对染铅大鼠血清 Ig G 含量的影响(图 2)
与对照组相比,染铅组大鼠血清 Ig G 含量显着降低,差异显着(P<0.05);与染铅组比较,三个补钙组血清 Ig G 含量均上升,试验Ⅲ组差异达显着水平(P<0.05)。
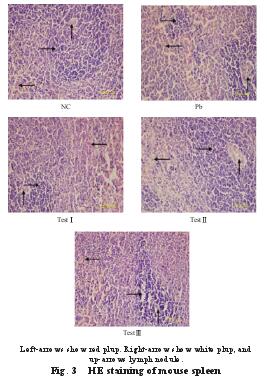
2.4 不同剂量的钙对染铅大鼠脾脏组织形态的影响(图 3)
对照组脾脏皮髓交界明显,白髓和红髓中可见明显的淋巴细胞。与对照组比较,染铅组大鼠脾脏淋巴细胞减少,红白髓交界不明显,白髓和红髓中淋巴细胞也明显减少,有部分溶解现象,排列稀疏,淋巴小结很少形成。与染铅组比较,试验Ⅱ组红白髓分界比较明显,淋巴细胞增加;但试验Ⅲ组淋巴结有明显分散现象,试验Ⅰ组红白髓分界模糊,淋巴细胞明显略有减少。
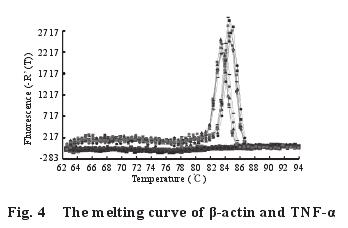
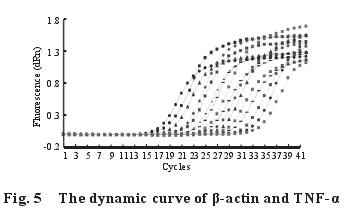
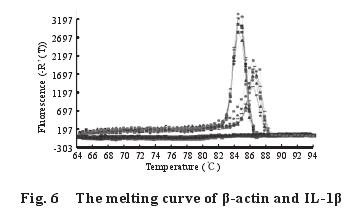
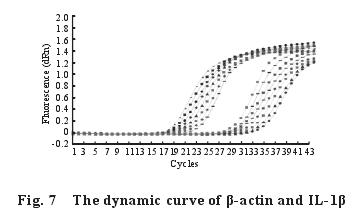
2.5 不同剂量的钙对染铅大鼠脾脏中细胞因子TNF-α、IL-1β、IL-6 m RNA 表达量的影响2.5.1 脾脏中细胞因子 TNF-α、IL-1β、IL-6 基因的熔解曲线与扩增曲线(图 4~9):β-actin、TNF-α、IL-1β、IL-6 m RNA 的熔解曲线有明显的单峰、无杂峰,说明引物符合要求,有较好的特异性、无二聚体;扩增动力学曲线平稳、拐点清析,符合要求。
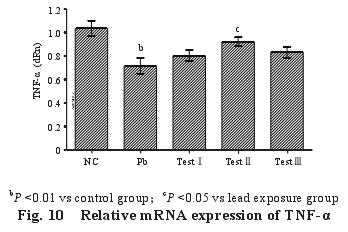
2.5.2 脾脏 TNF-α m RNA 的表达量(图 10):与对照组比较,染铅组大鼠脾脏中 TNF-α m RNA 的相对表达量极显着低于对照组(P<0.01);与染铅组比较,三个试验组大鼠脾脏中 TNF-α m RNA的相对表达量均升高,其中试验Ⅱ组显着升高(P<0.05)。
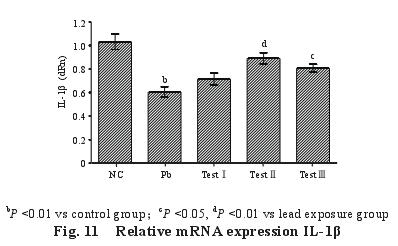
2.5.3 脾脏 IL-1β m RNA 的表达量(图 11):与对照组比较,染铅组大鼠脾脏中 IL-1β m RNA 的相对表达量极显着低于对照组(P<0.01);与染铅组比较,三个试验组大鼠脾脏中 IL-1β m RNA的相对表达量均升高,试验Ⅲ组差异达显着水平(P<0.05),试验Ⅱ组差异达极显着水平(P<0.01)。
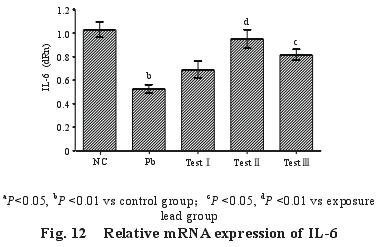
2.5.4 脾脏 IL-6 m RNA 的表达量(图 12):与对照组比较,染铅组大鼠脾脏中 IL-6 m RNA 的相对表达量极显着低于对照组(P<0.01);与染铅组比较,三个剂量染铅组大鼠脾脏中 IL-6 m RNA的相对表达量都有所升高,试验Ⅲ组显着高于模型组(P<0.05),试验Ⅱ组极显着高于模型组(P<0.01)。
3 讨 论
脾脏的脏器指数、血液中血细胞总数、血清中免疫球蛋白 Ig G 均是反映机体免疫功能强弱的重要指标。脾脏指数的高低直接取决于其中淋巴细胞增殖的程度,而血清中免疫球蛋白 Ig G 在体液免疫中发挥着不可替代的作用,具有预防特异性免疫功能,并参与机体非特异免疫,其水平可直接反映体液免疫力的强弱[11-13].由本试验结果可知,大鼠染铅一定时间后脾脏指数、白细胞总数、免疫球蛋白 Ig G 均降低,而补充一定剂量钙后,可使大鼠脾脏指数、白细胞总数和免疫球蛋白 Ig G 显着升高,说明钙能够缓解铅造成的免疫指标的异常变化,从而提高机体的免疫功能。
另外,大鼠染铅后淋巴细胞减少,细胞受到损伤,红髓和白髓分界不清,而补充一定剂量钙后,淋巴细胞增加,红髓和白髓分界不同程度变清晰,说明补充适量的钙,脾脏的病理性变化得到了明显改善。
本试验中染铅组大鼠脾脏中 TNF-α、IL-1β及 IL-6 m RNA 的表达水平均低于对照组,达到极显着水平,与其他学者研究结果一致。补充适量的钙明显提高铅暴露大鼠脾脏中 TNF-α、IL-1β及 IL-6 基因 m RNA 的相对表达量。研究报道,Pb在机体吸收过程中,与 Ca 等元素共用细胞同一离子转运通道,存在相互竞争抑制作用[14],因此钙调控这些基因表达变化的原因可能是由于钙竞争铅的作用位点,干扰铅的吸收,进而缓解铅的毒性,但深入的机制还需进一步研究。
[参 考 文 献]
[1] Ashry KM, El-Sayed YS, Khamiss RM, et al. Oxidativestress and immunotoxic effects of lead and theiramelioration with myrrh[J]. Food Chem Toxicol, 2010,48:236-241.
[2] 蒋玉红, 刘凯, 王涛, 王亚秋。 铅中毒儿童外周血 T 淋巴细胞免疫活性改变及临床意义[J]. 中国儿童保健杂志, 2006,14:520-521.
[3] 钟振伟, 王净。 长期低剂量铅暴露对小鼠细胞免疫功能的影响[J]. 广东医学院学报, 2002, 20:338.
[4] Gao D, Mondal TK, Lawrence DA. Lead effects ondevelopment and function of bone marrow-derived cellspromote Th2 immue response[J]. Toxicol Appl Pharmacol,2007, 222:67-69.
[5] Colomer J, Agell N, Engel P, et al. Calmodulinexpression during proliferative activation of human Tlymphoeytes[J]. Cell Calcium, 1993, 14:609-618.
[6] Seales E, Micoli KJ, Mcdonald JM. Calmodulin is acritical regulator of osteoclastic differentiation,function and survival[J]. J Cell Biochem, 2006, 97:45-55.