
研究表明,当血管壁的完整性遭到破坏时,狭窄局部的血管壁切应力( wall shear stress,WSS) 过高导致与血流接触的内膜损伤,可以诱发内皮细胞异常表达组织因子( tissue factor,TF)[1,2,3,4]。本研究应用套扎法建立大鼠颈总动脉狭窄模型,应用免疫组化和原位杂交法结合图像分析,对血管狭窄后切应力诱导内皮细胞 TF 早期表达规律进行了初步在体研究。
1 材料与方法
1. 1 实验动物与分组 SPF 级 SD 雄性大鼠 45 只,质量 320 ± 18. 5g,由第三军医大学实验动物中心提供。随机数字法分为对照组( C 组,n =5) 、狭窄组( S组,n =40) ,狭窄组分 0. 25、0. 5、1、2、4、8、16、24 h,8个时相点,每个时相点各 5 只大鼠。
1. 2 狭窄模型制作及标本采集 以 2. 5% 戊巴比妥钠 40 mg/kg 体重腹腔注射麻醉,待静卧后睫毛反射消失,仰位固定。无菌条件下,颈部备皮消毒后,颈部正中行长约 2. 5 cm 纵行切口,逐层分离,游离出左侧颈总动脉中段长 8 ~ 10 mm,套入纵形剖开的内径约0. 3 mm,长 3 mm 的硅胶管,外用 4 号丝线双重扎紧,复位后缝皮。分别在术后 0. 25 h、0. 5 h、1 h、2 h、4 h、8 h、16 h、24 h,8 个时相点,使用 TS420 型多普勒血流仪,1. 5 prb 探头,检测狭窄下游 5 mm 内的每分平均血流量 Q,检测时小心游离出颈总动脉外膜的疏松结缔组织,保持探头与血流方向垂直,每例检测约5 ~ 10min,待显示平稳时记录数字,得到每分平均血流量Q。随后在 Digitex 数字减影血管成像系统下,仰位固定,用自制导管( 直径约 1. 5 mm) 刺入左心室,快速注射 1 ml 碘佛醇( 240 mg/ml) ,即时进行正位数字减影血管造影( Digital subtraction angiography,DSA) ,测量正常和狭窄血管内经 D,计算出狭窄程度。C 组只分离左颈总动脉,进行 Q 和 D 值的测量。随后采用复合固定液( 4% 多聚甲醛,1‰DEPC,0. 1 mol/L PBS,pH7. 4) 约 30 ml 直接低压灌注,0. 1 h 后取下狭窄段血管固定,梯度酒精脱水,二甲苯透明,浸蜡,常规石蜡包埋,切片厚度 6 μm。
1. 3 切应力计算 把测得在体血管内径( D) 和每分平均血流量( Q) 代入 Poiseiulle 流体公式计量动脉平均壁切应力: Tw= 32ηQ / πD3( 血液黏稠度 η = 0. 035dynes. s / cm2. 5]) 。
1. 4 TF mRNA 采用原位杂交法检测 石蜡切片常规脱蜡至水并水化后,参照试剂盒说明,3% 柠檬酸新鲜稀释的胃蛋白酶 37. 0 ℃消化 0. 5 h,预杂交液恒温箱40. 0 ℃ 6 h,TF 寡核苷酸探针( MK3023,武汉博士德生物工程公司提供) ,杂交液恒温箱内 42. 0 ℃杂交 8h,封闭液 37. 0 ℃ 孵育 0. 5 h,生物素化鼠抗地高辛37. 0 ℃ 孵育 1. 0 h,滴加 SABC 复合物 37. 0 ℃ 孵育0. 5 h,生物素化过氧化酶 37. 0 ℃ 孵育 0. 5 h,DAB 显色( 试剂盒 AR1022,武汉博士德生物工程公司提供) 。按试剂盒提供的已知阳性片作为阳性对照,以 PBS 代替杂交液作为阴性对照。TF mRNA 阳性结果为细胞浆出现棕黄色颗粒。
1. 5 TF 蛋白采用免疫组织化学染色检测 石蜡切片脱蜡至水并水化,参照试剂盒说明,3% 过氧化氢室温下孵育 0. 25 h,浸入 0. 01 mol/L 枸橼酸盐缓冲液( pH6. 0) ,微波炉中火加热至沸腾,反复 3 次,每次间隔0. 1 h,10% 羊血清 37. 0 ℃ 孵育 0. 25 h,分别加入一抗兔抗 TF 多克隆抗体( BA1714,武汉博士德生物工程公司提供,稀释度 1∶120) ,4. 0 ℃冰箱放置 8 h,生物素标记的山羊抗兔 IgG 抗体( 二抗) 20. 0 ℃ 孵育 0. 5h,链霉菌抗生物蛋白-过氧化物酶溶液 20. 0 ℃ 孵育0. 5 h,DAB 显色( 试剂盒 AR1022,武汉博士德生物工程公司提供) 。按试剂盒提供的已知阳性片作为阳性对照,以 PBS 代替杂交液作为阴性对照。TF 阳性结果为细胞胞浆着色,呈棕黄色。
1. 6 图像分析 以细胞浆出现的棕色细颗粒为阳性染色,采用 Leica Qwin 病理图像分析系统测定阳性表达物的平均灰度值( mean gray,MG) ,灰度值 0( 黑色,表达最强) ,255( 白色,无表达) 。每张切片测量前均用该片空白区校正并调节光亮度,以达到不同指标测量标准相同。本实验各组切片空白区灰度值平均为245,每组抽取 5 张切片,在 630 × 光镜下随机选取 4个区域,测定内膜的 MG,以相对平均灰度值( RMG)表示,即阴性对照 MG 减去实验 MG。
1. 7 统计学分析 数据以均数 ± 标准差( x ± s) 表示,SPSS 16. 0 统计软件处理,组间均数比较用单因素方差分析,以 P <0. 05 确定有显着性。
2 结 果
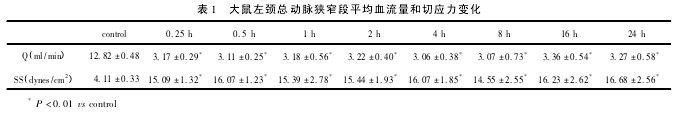
2. 1 血流量和切应力变化 DSA 测得静息状态下大鼠左颈动脉正常血管内径为 1. 14 ±0. 05 mm,各组狭窄血管内径为 0. 21 ±0. 02 mm,本模型的平均狭窄率为 82%。静息状态下大鼠左颈动脉狭窄前和狭窄后各时相血流量见表 1。对照组和狭窄组的血流量和切应力有显着性差异( P < 0. 01) ,狭窄后各组间血流量和切应力无显着性差异( P >0. 05) 。
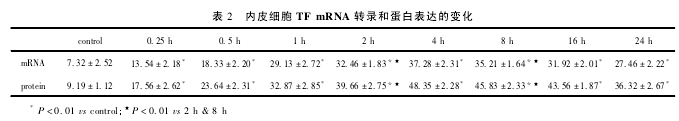
2. 2 TF mRNA 转录和蛋白的表达变化 正常对照组颈总动脉内膜内皮细胞的 TF mRNA 和蛋白有微量表达,狭窄 0. 25 h 后,检测到颈动脉内膜内皮细胞表达的 TF mRNA 和蛋白增强( P < 0. 01) ,主要存在于胞浆,随着狭窄时间的延长,阳性细胞数及着色程度逐渐增加,狭窄后4 h 达到峰值( P <0. 01,表2) ,以后逐渐下降,但各时相点与正常组相比均显着升高( P <0. 01) ,狭窄后 24 h,相对平均灰度值仍然高于对照组( P <0. 01,表 2) 。
3 讨 论
血液动力学作用在新生血管形成、血管壁结构重建以及动脉粥样硬化的发生发展中起着肯定性的作用[6]。血流作用于动脉的力可以分解成两个主要的向量[7,8]: 一是垂直于管壁的代表压力的向量,二是作用于内皮细胞表面与管壁平行因血液的沾滞性而产生的摩擦力,即 WSS。血管壁的所有成份( 内皮细胞、平滑肌细胞、细胞外基质等) 都承受脉动压力产生的伸张,但内皮细胞表面所承受的力以 WSS 为主[[9,10]。
硅胶管套扎大鼠颈总动脉中段造成的狭窄不损伤血管内膜[11],大鼠左颈内动脉的近心段长直均匀且无分支,可以应用 Poiseiulle 流体公式计量平均WSS[5]。运用数字减影血管造影和多普勒血流仪能精确地测量在体血管内径和每分平均血流量,计算出准确的狭窄程度和切应力。本模型造成的狭窄达到重度,局部切应力比狭窄前增强了 3. 8 倍,15 min 后TF 的 mRNA 转录和蛋白开始表达,证实了局部的切应力过高导致血管内膜损伤,是诱发内皮细胞异常表达组织因子,导致血栓形成和斑块产生[5,12,13]。
体外研究表明,内皮细胞 TF mRNA 和蛋白在基础状态下几乎检测不到,给予切应力诱导后表达上调,说明 TF 基因上调的诱发与内皮细胞的切应力变化有关[14,15]。本实验在大鼠颈总动脉狭窄段的高切应力区观察到内膜的 TF 的 mRNA 转录和蛋白表达均明显增强,约 4 h 达到峰值,说明只要血管局部狭窄,造成血流紊乱,切应力发生了改变,就可以早期诱导TF 基因表达。体外实验研究表明,这可能主要与即早基因家族( immediate early genes,IEGs) 的 Egr-1 和Sp1 有关[15],转录因子核因子 κppa-B( NF-κB) 和活化蛋白-1( AP-1) 活化后也可以参与其上调[16]。多种因素使内皮细胞 TF 基因表达上调,血管损伤后,在多种炎性因子如白介素-1( IL-1) 、脂多糖( LPS) 、肿瘤坏死因子-α( TNF-α) 、干扰素( INF) 、内皮细胞黏附分子-1( ICAM-1) 、前列环素( PGI2) 等作用下,血管内皮细胞TF 基因表达也可以增强[17-20]。
参考文献
[1] KAWAHARA D,MATSUDA T. Hydrodynamic shear-stress-dependent retention of endothelial and endothelial progenitorcells adhered to vascular endothelial growth factor-fixed sur-faces[J]. Biomed Mater Res B Appl Biomater. 2012,100( 5) : 1218-1228.
[2] DELA PAZ NG,WALSHE TE,LEACH LL,et al. Role ofshear-stress-induced VEGF expression in endothelial cellsurvival[J]. Cell Sci,2012,15; 125( 4) : 831-843.
[3] MAZZOLAI L,SILACCI P,BOUZOURENE K,et al. Tissuefactor activity is upregulated in human endothelial cells ex-posed to oscillatory shear stress [J]. Thromb Haemost,2002,87( 6) : 1062-1068.
[4] GRABOWSKI EF,REININGER AJ,PETTERUTI PG,et al.Shear stress decreases endothelial cell tissue factor activityby augmenting secretion of tissue factor pathway inhibitor[J]. Arterioscler Thromb Vasc Biol,2001,21( 1) : 157-162.





