
低氧预适应是指一般通过预先给予机体一个温和的( 亚致死性) 缺血/低氧刺激,可以增强机体对随后更严重的( 致死性) 缺血/低氧刺激的耐受力的现象。Lü 等[1]在上世纪六十年代发现小鼠经急性重复低氧暴露,可以使小鼠的低氧耐受时间增加。
利用急性重复低氧模型发现小鼠低氧耐受的极限约为 6% 氧气浓度,而低氧预适应小鼠的体温则降低到 25℃左右[2]。Lü 等提出有组织细胞机制参与低氧预适应的形成,能量代谢的变化则可能是低氧预适应形成的一个关键点[3]。通过基因表达调控等使组织细胞从正常代谢状态转变为低代谢状态,这种变化机制可能是在极端条件下细胞面临生死抉择时的基因表达的变化。
蛋白磷酸酶( protein phosphatase,pp) 1 是脑内含量第二丰富的丝氨酸/苏氨酸磷酸酶,pp1 是真核细胞中高度保守的调节细胞能量使用的酶[4,5]。哺乳动物细胞中有三种 pp1 基因,它们分别编码pp1α,pp1γ,和 pp1β / σ。其中 pp1γ 表达变化可能是调节细胞能量变化的最初的关键变化[5]。海马组织是大脑对低氧/缺血最为敏感的部位,本研究利用急性重复低氧小鼠模型,研究成年小鼠海马组织中pp1γ 的变化,并探讨其与低氧耐受形成的关系。
材料和方法
1 材料
18 ~ 22 g 雄性昆明小鼠( 6 ~ 8 周) 购于内蒙古大学实验动物中心。Trizol,superscript III 购自 In-vitrogen 公司; Qiagen DNA extraction kit 购自 Qiagen公司; EZ DNA Methylation kit 购自 ZYMO Research公司; 2X Real-time PCR Mix 购自 Bioner 公司; 兔源PP1γ 多克隆抗体购自 Santa Cruze 公司; 鼠源 β-actin单克隆抗体购自 Sigma 公司; 辣根过氧化物酶标记的羊抗兔的二抗和驴抗鼠的二抗购自北京博奥森生物技术有限公司; BCA 试剂购自 Pierce 公司; pp1 活力试剂盒为 Genmed Scientifics 国产试剂。
2 方法
2. 1 低氧预适应小鼠模型的复制 雄性小鼠随机分为 H0、H1 和 H4 组,按我中心传统方法复制模型[6-9],即 H0 组不进行低氧暴露( 空白对照组) ,H1组低氧暴露 1 次( 实验对照组) ,H4 组低氧暴露 4 次( 低氧预适应组) 。低氧结束断头取脑,剥离海马。
2. 2 定量 PCR ( Real-time PCR) 用 Trizol 提取细胞总 RNA,紫外分光光度计检测 RNA 纯度和含量。按照逆转录反应试剂盒进行反转录 PCR,得到 20 μlcDNA 产物 - 20℃ 保存。使用 ABI 公司的 96 孔板,每孔依次加入 cDNA 1 μl,2 ×12. 5 μl,3’和 5’端引物各 1 μl,引物序列如下,无菌水 9. 5 μl,在 ABI7900 Real-time PCR 反应仪上反应,每个样本设 3 个复空。反应参数: 94℃预变性3 min,再进行92℃,30s; 54. 5℃ ,35 s; 72℃ ,30 s( 40 cycles) ,最后 72℃ 延伸 5 min 停止反应。
PP1γ F: GAGAACGAGATCCGAGGACTC, R:CGTATTCAAACAGACGGAGCAA; β-actin F: GGCT-GTATTCCCCTCCATCG, R: CCAGTTGGTAACAAT-GCCATGT。
2. 3 蛋白免疫印迹( Western Blot) 检测蛋白表达使用碧云天公司的 RIAP buffer 裂解海马组织,用 BCA 试剂测定蛋白含量,加上样缓冲液调到各组蛋白量一致,10% SDS-PAGE,压缩胶20 mA,分离胶 30 mA,电泳结束后 400 mA 转移至 PVDF 膜,预染蛋白 marker 确定蛋白分子量标准位置。用含10% 脱脂奶粉 TTBS 液封闭,TTBS 洗 3 次,每次 10min; 加入 PP1γ ( 1 ∶ 500 ) 或 β-actin ( 1 ∶ 1000 ) 一抗,4℃ 孵育过夜,TTBS 洗 3 次,每次 10 min; 1∶ 10000 加入辣根过氧化物酶标记相应的二抗,37℃ 孵育 1 h,TTBS 洗 3 次,每次 10 min; 按 Pierce 公司的 ECL 试剂盒进行荧光显色反应。暗室中曝光,显影,定影。用分析软件 bandscan 分析每个条带的灰度值。
2. 4 pp1 磷酸酶活性活力实验 按照国产试剂公司 Genmed Scientifics 生产的 pp1 活力检测试剂盒提供的方法提取蛋白并检测各组小鼠海马组织 pp1 磷酸酶活性活力。
2. 5 pp1γ 启动子区( 95 bp ~ 321 bp) DNA 甲基化测序( Bisulfite-modified DNA sequencing,BMDS) 利用 Qiagen DNA extraction kit 从小鼠海马组织提取基因组 DNA,按照 EZ DNA Methylation kit 将基因组DNA 进行转换,转换后的 DNA 进行巢式 PCR 扩增,外部引物为 5’-AGGGGTGATTTAGTGTTGAA-3’和5’-TCTCACTCGTCCTCCTTCCTCA-3’; 内部引物为5’-GTTAGATTTTTGTTTTTAAGTAGTAGAGT-3’,和 5’-CTTCCTCCTCCTCTCGCCACT-3’。PCR 产物纯化后连接入 PCR2. 1 载体中,转化 E. Coli 后挑取 10 个阳性克隆送公司测序。
统计学处理: 结果以 x珋 ± s 表示,用 SPSS10. 0 数据统计软件 ANOVA 和 Tukey 对组间数据进行处理和分析,P <0. 05 为差异有统计学意义。
结 果
1 低氧预适应小鼠海马组织 pp1γ mRNA 表达的变化
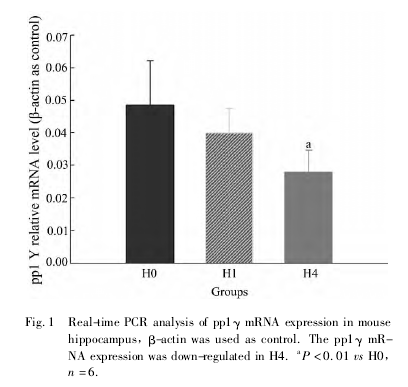
pp1γ mRNA 相对丰度以 delta-delta CT 表示,其中以 β-actin 为内参( Fig. 1) 。pp1γ1 mRNA 相对丰度在 H0 组为 0. 049 ± 0. 013,H1 组为 0. 040 ±0. 008,H4 组为 0. 028 ± 0. 007,H4 组与 H0 组相比,差异有统计学意义( P <0. 01,Fig. 1) 。
2 低氧预适应小鼠海马组织 pp1γ 蛋白表达的变化
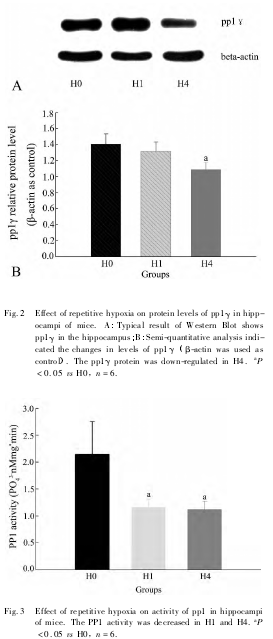
pp1γ 蛋白丰度通过 Western Blot 来检测( Fig. 2A) ,其相对丰度以目的蛋白丰度/beta-actin 蛋白丰度表示。pp1γ 蛋白相对丰度在 H0 组为 1. 41 ±0. 18,H1组为 1. 32 ±0. 19,H4 组为 1. 09 ±0. 11。H4 组 pp1γ蛋白水平降低,与 H0 组相比,差异有统计学意义( P< 0. 05,Fig. 2B) 。
3 低氧预适应小鼠海马组织 pp1 磷酸酶活性的变化
pp1 磷酸酶活性实验检测 H0 组、H1 组和 H4 组海马组织中 pp1 磷酸酶的活性,H0 组的活性为2. 15± 0. 61,H1 组的活性为 1. 16 ± 0. 15,H4 组的活性为1. 12 ± 0. 16,H1 组和 H4 组分别与 H0 组相比,差异有统计学意义( P < 0. 05) ,说明急性重复低氧预适应使 pp1 磷酸酶的活性降低( Fig. 3) 。
4 低氧预适应小鼠海马组织 pp1γ 启动子区( 95 ~321 bp) 甲基化的改变
利用 Methyl Primer Express v1. 0 软件对 pp1γ 启动子区 416 bp 片段进行分析( 95 ~321 bp) ,发现该片段包含 49 个 CpG 点,该段 CpG 二核苷酸高于0. 6符合 CpG 岛特征。利用 Bisulfite-Modified DNASequencing 研究发现 H0、H1 和 H4 三组 pp1γ 启动子区( 95 ~321 bp) 甲基化情况未见显着差异,而该段第12 位和38 位 CpG 都为半甲基化状态( Fig. 4) 。

讨 论
神经细胞的正常功能依赖于持续的氧和糖的供给以产生 ATP 去维持细胞内外的离子分布差异,低氧会因为 ATP 产生的不足而使神经细胞受到损伤[10]。因此,缺血/低氧环境下细胞存活的关键是避免 ATP 的快速下降,而神经细胞可以通过改变基因表达变化来改变其代谢策略使细胞在特殊环境下实现生存[8]。pp1γ 对于神经细胞能量代谢有重要作用[5],pp1γ 转录起始点上游有一段 300 bp 的 GC 含量高达 79% 的区域,这段高 GC 区控制着 pp1 的转录[11]。我们先前研究显示低氧预适应降低海马脑区 DNMT3A 和 DNMT3B 的表达[12]。本研究主要讨论 pp1γ 在低氧预适应过程中作用及其变化与其DNA 甲基化的关系。
Taylor 等[13]研究显示低氧条件下 pp1γ 表达降低,与 Taylor 等研究结果相似,我们的研究结果显示低氧预适应可以使 pp1γ 在 mRNA 和蛋白水平表达均降低。同时我们研究显示 pp1 的磷酸酶的活力降低,虽然我们没有直接检测 pp1γ 磷酸酶的活力的变化,但从 pp1 活力的变化,我们可以推测低氧预适应过程中 pp1γ 磷酸酶的活力可能降低。pp1γ 靶蛋白之一的环腺苷酸应答原件结合蛋白( CREB) 在神经细胞功能中有重要作用,CREB 的功能的变化是通过其丝氨酸( Ser-133) 磷酸化变化实现的[5],而其丝氨酸的去磷酸化作用是由 pp1γ 调节的,一些与代谢相关基因,如 Bcl-2 等通过 CREB 参与到低氧或氧化抑制条件下的神经保护[14,15]。利用我们的急性低氧预适应小鼠模型发现小鼠海马 CREB 的磷酸化水平升高[16],因此 pp1γ 的变化可能是预适应早期项( early phase) 形成的关键事件。
DNA 甲基化是真核细胞基因表达调控的一种重要的方式,DNA 甲基化在神经系统中有重要作用,其在神经发育和分化,突触可塑性,学习记忆以及维持神经元的生存等相关基因的表达方面具有重要作用[17],催化 DNA 甲基化的酶为 DNA( 胞嘧啶-C5) 甲基转移酶[18]。我们先前研究报道低氧预适应过程中,DNA 甲基转移酶 3A 和 3B 表达降低[12],同时 pp1γ 启动子区符合 CpG 岛特征[11],因此我们对pp1γ 启动子区( 95 bp ~ 321 bp) 进行了 BMDS 研究。
结果
显示低氧预适应没有改变其甲基化状态,因此我们推测急性重复低氧在短时间内( 几个小时) 没有影响其启动子区( 95 bp ~321 bp) 甲基化状态,其表达变化可能是由其它因素引起的。通过急性重复低氧小鼠模型观察到低氧预适应可以使脑保护基因表达上调并使脑损伤基因表达下调,上调的基因一般为低代谢/抑制凋亡的基因[8]。在能量代谢调节中有重要作用的 pp1γ 表达的下调,正是通过低代谢来实现神经保护的。虽然 DNA 甲基化在基因表达调控中有重要作用,但本研究观察到 pp1γ 表达变化不依赖于其动子区( 95 bp ~ 321bp) 甲基化状态的改变,其表达变化的原因有待于进一步研究。
参 考 文 献
[1]Lu GW. Tissue-cell adaptation to hypoxia [J]. Adv Pathophysiol,1963,1: 197 - 239.
[2]Cheng F,Xie S,Guo M,et al. Altered glucose metabolism andpreserved energy charge and neuronal structures in the brain ofmouse intermittently exposed to hypoxia [J]. J Chem Neuroanat,2011,42: 65 - 71.
[3]Lu GW,Yu S,Li RH,et al. Hypoxic preconditioning: a novel in-trinsic cytoprotective strategy [J]. Mol Neurobiol,2005,31: 255- 271.





