
近年来,随着基因敲除及转基因技术的兴起及发展,小鼠作为实验动物在心血管疾病的研究中发挥越来越重要的作用. 主动脉弓缩窄术(transverseaortic constriction,TAC)是目前常用的研究压力过负荷型心肌肥大及心力衰竭的模型[1]. TAC 所致的病理性心肌肥大不是一个静止状态,而是一个进行性发生发展的过程. 心脏在受到过度的压力负荷时会发生代偿性心肌肥大(向心性肥大),此时如无有效的干预措施,代偿性心肌肥大会进展为失代偿性心肌肥大(离心性肥大),甚至心力衰竭[2]. 小鼠TAC 后发生心肌肥大的时间及严重程度主要与主动脉弓缩窄程度直接相关. 结合国内外的报道,目前 TAC 时采用的缩窄针主要有 26G 及 27G 两种型号[3-4],但是由于小鼠的个体差异以及人为操作的不同,即使采用相同的缩窄针也可能造成不一致的缩窄程度.
因此,建立客观评价小鼠主动脉弓缩窄程度的方法便成为影响整个实验成败的前提及基础. 本研究采用超声多普勒检测方法,通过颈右动脉与颈左动脉血流之比来评价 TAC 的成败及程度,并在术后 2 周对主动脉弓不同缩窄程度的小鼠进行超声心动图及心脏形态学观察,了解主动脉弓缩窄程度与心肌肥大发生发展的相关性,为 TAC 在心血管疾病研究中的应用奠定基础.
1 材料和方法
1.1 材料
1.1.1 实验动物及分组
6~8 周清洁级雄性 C57BL / 6 小鼠 60 只, 体重22~25 g, 由北京大学医学部提供 [生产许可证号SCXK(京)2011-0012]. 于 12 h 明暗交替,室温 18~23℃动物房饲养. 小鼠随机分为 3 组,分别为假手术组(sham)、26G 缩窄针主动脉弓缩窄组 (TAC26G组)27G 缩窄针主动脉弓缩窄组 (TAC27G组),每组 20 只.
1.1.2 主要仪器
ALC-V8S 型小动物呼吸机(上海奥尔科特生物技术有限公司),ALC-HTP 型动物恒温系统(上海奥尔科特生物技术有限公司),LG-PS2 鹅颈冷光源(Olympus 公司,日本),显微手术器械 (上海医疗器械有限公司),AE-100 电子分析天平 (Mettler 公司,瑞士),VEVO 2100 超声仪(Visual Sonics 公司,加拿大).
1.2 方法
1.2.1 主动脉弓缩窄小鼠模型建立.
按照已有文献报道进行模型建立[5-6],采用氯胺酮(80 mg/kg)与甲苯噻嗪(15 mg/kg)混合,腹腔注射麻醉,小鼠麻醉后仰卧位固定于恒温垫上,经气管插管与小动物呼吸机连接(潮气量 0.5 ml/ 次,呼吸频率 105~110 次 /min). 于胸骨前正中打开胸腔,暴露主动脉弓部,在左颈总动脉与头臂干之间穿一 5-0 号丝线, 并紧贴血管上置一 26G 或 27G 缩窄针,用丝线将动脉与针头一起扎紧并迅速抽出针头,按照统一标准造成不完全缩窄,常规关胸,缝皮. 手术切口处用碘伏涂覆,待小鼠自主呼吸恢复后脱机.假手术组除不做缩窄外, 其余操作均与主动脉弓缩窄组相同.
1.2.2 超声多普勒检测小鼠颈总动脉流速
应用 VEVO 2100 超声仪及 40 MHz 高频探头对小鼠进行超声多普勒检测, 获取血液流速的二维及彩色图像. 根据右侧颈动脉流速与左侧颈动脉流速之比来判断小鼠 TAC 的成败及手术的一致性. 颈右动脉 / 颈右动脉 (RCA/LCA) 为 5~7 者入 TAC26G组,RCA/LCA 为 8~10 者入 TAC27G组.
1.2.3 超声心动图检测小鼠心脏结构及功能
应用 VEVO 2100 超声仪及 40 MHz 高频探头于术后 2 周对小鼠进行超声心动图检测,获得 M 型超声心动图图像,检测舒张期室间隔厚度(IVSd);舒张期左心室后壁厚度(LVPWd);左心室舒张期室内径(LVIDd);射血分数(EF)及短轴缩短率(FS).所有操作均由超声医师采用双盲法进行. 所有检测均取6 个不同心动周期的平均值.
1.2.4 标本收集与处理
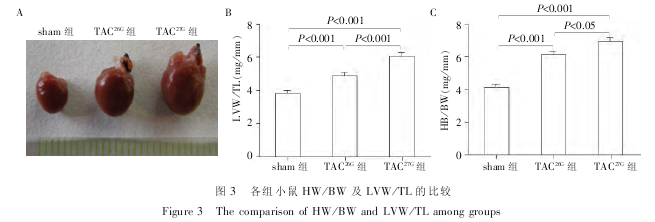
术后 2 周将小鼠麻醉后固定,称重,取其心脏组织,拍照后按照统一标准修剪非心脏组织,称重,计算心脏重量 / 体重(HW/BW). 修剪去左右心房及右心室, 称量左心室重量, 计算左心重量 / 胫骨长度(LVW / TL).
1.3 统计学方法
应用 GraphPad Prism 5 统计软件包进行数据处理,计量数据用均数 ± 标准误(x ± sx)表示. 单因素方差分析进行组间变异度分析, 两两比较采用Tukey 检验. P≤0.05 为差异具有统计学意义.
2 结 果
2.1 超声多普勒对小鼠主动脉弓缩窄程度的评价与比饺.
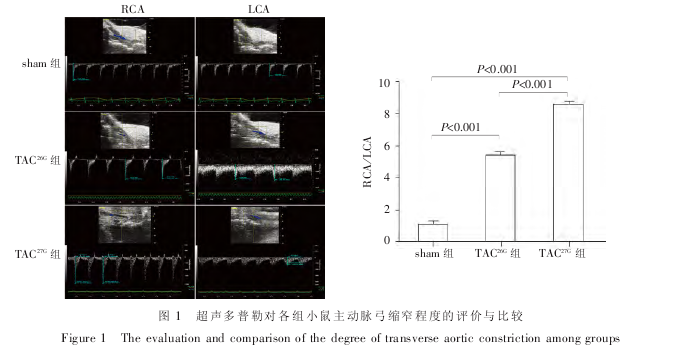
主动脉弓缩窄术后 6 h, 分别对各组小鼠行超声多普勒检测右侧及左侧颈动脉流速. 结果显示,RCA / LCA sham 组 1.037 ± 0.113,TAC26G组 5.365 ±0.587,TAC27G组 8.545 ± 0.601,3 组比较差异有统计学意义(F = 356.1,P < 0.001). 与 sham 组(n = 20)比较,TAC26G组(n = 18)及 TAC27G组(n = 16)RCA/LCA 均 显 着 增 加 , 差 异 具 有 统 计 学 意 义 (P <0.001);TAC27G组 RCA/LCA 较之 TAC26G组差异也具有统计学意义(P < 0.001,图 1).
2.2 超声心动图对小鼠心脏结构及功能的评价与比较
主动脉弓缩窄手术后 2 周,采用超声心动图对各组小鼠心脏结构及功能进行检测. 结果显示,各指标 3 组比较差异均有统计学意义(IVSd:F = 22.09,P < 0.01;LVPWd:F = 18.01,P < 0.01;LVIDd:F =34.68,P < 0.01;EF:F = 55.04,P < 0.01;FS:F =20.47,P < 0.01). 与 sham 组(n = 20)比较,TAC26G组(n = 18)及 TAC27G组(n = 16)IVSd 及 LVPWd 均显着增加, 差异具有统计学意义 (P < 0.001, 图 2A~C); 与 sham 组相比,TAC26G组 LVIDd 明显减小,而TAC27G组 LVIDd 则明显增加,差异具有统计学意义(图 2A、D); 与 sham 组相比,TAC26G组 EF 及 FS 均显着增加,而 TAC27G组 EF 及 FS 均显着下降,差异具有统计学意义(图 2E、F).
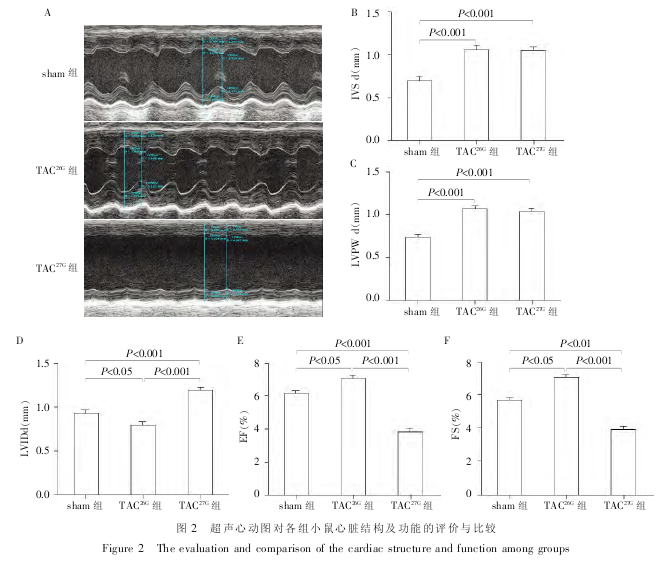
结果提示,采用 26G 缩窄针行小鼠主动脉弓缩窄术,小鼠 RCA/LCA 为 5~7,术后 2 周,小鼠室间隔及左室后壁增厚,左心腔缩小,收缩功能增强,发生了典型的向心性肥大;采用 27G 缩窄针行小鼠主动脉弓缩窄术,小鼠 RCA/LCA 为 8~10,术后 2 周,小鼠室间隔及左室后壁较之 TAC26G组有所下降,左心腔显着扩大,收缩功能下降,发生了典型的离心性肥大.
2.3 各组小鼠 HW / BW 及 LVW / TL 的比较
结果显示,HW/BW 及 LVW/TL 3 组比较差异均有统计学意义(F = 54.93,P < 0.01;F = 59.84,P <0.01). 与 sham 组相比,TAC26G组及 TAC27G组均发生明显的心肌肥大(图 3A),HW/BW 及 LVW/TL 均显着增加,差异具有统计学意义(P < 0.001);TAC27G组较之 TAC26G组其 HW/BW 及 LVW/TL 明显增加,差异也具有统计学意义(图 3B、C).
3 讨 论
病理性心肌肥大所致的心力衰竭是目前心血管疾病致死的主要因素之一[7-8]. 研究病理性心肌肥大的发生发展机制, 寻找治疗及延缓心力衰竭发展进程的生物学靶点是目前心血管疾病研究的首要目标. 压力过负荷所引起的病理性心肌肥大是一个从代偿逐渐进展为失代偿最终导致心力衰竭及死亡的连续性过程[2]. 不同阶段的病理性心肌肥大,其治疗及预防亦不尽相同. 因此,不同疾病阶段相应动物模型的建立对于病理性心肌肥大的研究具有十分重要的指导作用.
小鼠主动脉弓缩窄致压力后负荷增加所引起的病理性心肌肥大是目前最常见的研究心肌肥大及心力衰竭的动物模型[9]. 造模是否成功对整个实验的成败具有至关重要的作用,而影响造模成败的关键因素则是 TAC 的缩窄程度. 小鼠的主动脉主要有 3个分支,分别为右头臂动脉、左颈总动脉及左锁骨下动脉[10]. TAC 是指在右头臂动脉与左颈总动脉之间进行一定程度的缩窄,使左心室后负荷增加,从而复制病理性心肌肥大模型. TAC 一旦成功,右头臂动脉即可部分分流血液, 而左颈总动脉的血流则相应降低.因此,通过计算右侧颈总动脉血流与左侧颈总动脉血流之比即可反映 TAC 的成败及程度. 本实验根据小鼠的解剖特征, 采用超声多普勒的方法对小鼠 TAC 的缩窄程度进行量化、客观的评估,在实验初期即可准确判断手术的成模率及一致性. sham 组没有进行任何程度的缩窄, 其右侧颈动脉流速与左侧基本相同;26G 缩窄针一般认为可以造成中度程度的缩窄, 其右侧颈动脉流速与左侧之比为 5~7;27G缩窄针一般认为可以造成重度程度的缩窄,其右侧颈动脉流速与左侧之比为 8~10. 我们的研究结果为中度缩窄及重度缩窄提供了可靠的量化指标,避免了小鼠个体差异及人为操作造成的造模失败.
TAC 的缩窄程度与心肌肥大的严重程度及肥大出现的时间窗密切相关[11-12]. 缩窄度高则肥大出现的时间早并且进展至失代偿期所用的时间短,缩窄度低则肥大出现的时间晚并且代偿期维持的时间长. 已有研究报道,重度 TAC 2 周即可导致小鼠发生心力衰竭,而轻度 TAC 则需 8 周方可引起小鼠心功能下降[3,13]. 本研究分别采用 26G、27G 缩窄针对小鼠主动脉弓进行中度、重度缩窄,术后 2 周对小鼠行超声心动图检测,结果显示中度缩窄的小鼠发生典型的向心性肥大,重度缩窄的小鼠发生典型的离心性肥大. 心脏重量 / 体重及左心重量 / 胫骨长度是衡量心肌肥大的经典指标[14-15],小鼠解剖称重发现,与 sham 组相比,TAC26G组及 TAC27G组心脏重量 / 体重及左心重量 / 胫骨长度均明显增加,TAC27G组上述两个肥大指标较之 TAC26G组增加更为明显. 以上结果表明,病理性心肌肥大的发展阶段依赖于心脏承受的负荷,同时也为心肌肥大及心力衰竭相关研究如何选择缩窄程度提供一定的依据.
本研究建立了客观、准确评价小鼠主动脉弓不同程度缩窄模型的方法,在实验初期即可排除手术造成的组内差异对结果的影响,并研究了不同程度的缩窄度与心肌肥大所处阶段的相关性,对压力超负荷心肌肥大及心力衰竭相关研究动物模型的选择具有重要的指导作用.
[参考文献]
[1] Tarnavski O,McMullen JR,Schinke M,et al. Mouse car-diac surgery:comprehensive techniques for the generationof mouse models of human diseases and their applicationfor genomic studies [J]. Physiol Genomics,2004,16 (3):349-360
[2] Diwan A,Dorn GN. Decompensation of cardiac hypertro-phy:cellular mechanisms and novel therapeutic targets[J]. Physiology (Bethesda),2007,22(1):56-64
[3] 李晓梅,马依彤,杨毅宁,等. 小鼠主动脉弓缩窄模型的建立及评价[J]. 中国比较医学杂志,2008,18(11);24-29
[4] Zelarayan L,Renger A,Noack C,et al. NF-kappaB acti-vation is required for adaptive cardiac hypertrophy [J].Cardiovasc Res,2009,84(3):416-424
[5] Chintalgattu V,Ai D,Langley RR,et al. CardiomyocytePDGFR-beta signaling is an essential component of themouse cardiac response to load-induced stress [J]. J ClinInvest,2010,120(2):472-484
[6] Patten RD,Pourati I,Aronovitz MJ,et al. 17 Beta-estradi-ol differentially affects left ventricular and cardiomyocytehypertrophy following myocardial infarction and pressureoverload[J]. J Card Fail,2008,14(3):245-253
[7] Gary R,Davis L. Diastolic heart failure [J]. Heart Lung,2008,37(6):405-416
[8] MacIver DH. Is remodeling the dominant compensatorymechanism in both chronic heart failure with preservedand reduced left ventricular ejection fraction? [J]. BasicRes Cardiol,2010,105(2):227-234
[9] Li Y,Ha T,Gao X,et al. NF-kappaB activation is re-quired for the development of cardiac hypertrophy in vivo[J]. Am J Physiol Heart Circ Physiol,2004,287 (4);H1712-H1720
[10] DeAlmeida AC,van Oort RJ,Wehrens XH. Transverseaortic constriction in mice[J]. J Vis Exp,2010(38):1729[11] Liao Y,Ishikura F,Beppu S,et al. Echocardiographic as-sessment of LV hypertrophy and function in aortic-band-ed mice:necropsy validation[J]. Am J Physiol Heart CircPhysiol,2002,282(5);H1703-H1708
[12] Zhu Y,Li T,Song J,et al. The TIR / BB-loop mimetic AS-1 prevents cardiac hypertrophy by inhibiting IL-1R-medi-ated MyD88-dependent signaling [J]. Basic Res Cardiol,2011,106(5):787-799
[13] Toischer K,Rokita AG,Unsold B,et al. Differential cardiacremodeling in preload versus afterload [J]. Circulation,2010,122(10):993-1003
[14] Chen J,Shearer GC,Chen Q,et al. Omega-3 fatty acidsprevent pressure overload-induced cardiac fibrosisthrough activation of cyclic GMP / protein kinase G sig-naling in cardiac fibroblasts [J]. Circulation,2011,123(6):584-593
[15] Grote-Wessels S,Baba HA,Boknik P,et al. Inhibition ofprotein phosphatase 1 by inhibitor-2 exacerbates progres-sion of cardiac failure in a model with pressure overload[J]. Cardiovasc Res,2008,79(3):464-471





