
已有研究[1]显示,心肌梗死的发生与炎症反应相关.炎症反应是组织能够愈合的条件,但同时也能引起组织的进一步损伤,影响心室重塑,导致心肌梗死和心肌功能的下降[2].越来越多的证据表明,心肌组织损伤反应与先天免疫系统相关,包括多种受体家族.
目前研究较多的是 Toll 样受体家族,它能够识别微生物来源的保守序列.NLP 家族 pyrin 结构域 3 ( NLRP3) 是细胞质识别受体,通过形成复合体调节先天免疫反应和炎症.NLRP3 炎症体是多蛋白复合体,它能够活化炎症细胞因子白介素 1β( IL-1β) 和白介素 18( IL-18) 的前体.
活化的 NLRP3 炎症体也能够诱导细胞死亡[3].我们对心肌缺血缺氧状态下 NLRP3 在心肌成纤维细胞中的表达作一观察,为心肌梗死及心肌缺血的诊断和治疗提供分子理论研究基础.
1 材料与方法
1. 1 实验动物及主要试剂
Wistar 大鼠购自中国医科大学实验动物部,抗NLRP3 抗体和氯化钴购于 Sigma 公司,Trizol 试剂和引物合成购于 Invitrogen 公司,逆转录和 Real-time PCR 试剂盒购于 TaKaRa 公司,二抗购于北京中杉金桥生物技术有限公司,DMEM 培养基和血清购于 Hyclone 公司.
1. 2 大鼠心肌成纤维细胞的体外培养
予5%异氟醚气体将 Wistar 大鼠麻醉,摘除心脏,用无钙离子的 Tyrode 氏液逆行灌注,Ⅱ型胶原酶酶解心肌细胞.分离大鼠的心肌成纤维细胞,进行体外培养.
1. 3 大鼠心肌成纤维细胞缺氧诱导
将体外培养的原代大鼠心肌成纤维细胞分成两组: 实验组加入 100 μmol·L- 1氯化钴或在 5% 低氧孵箱中培养,模拟缺氧的细胞生存环境; 对照组采用普通培养基培养.24 h 后收集细胞.5% 低氧孵箱是充入氮气的细胞培养孵箱,能够将氧气含量控制在 5%,对细胞进行低氧培养.
1. 4 总 RNA 提取和反转录
收集两组大鼠心肌成纤维细胞,用 Trizol 提取总RNA,操作步骤按照 Invitrogen 公司 Trizol 说明书进行.紫外分光光度计测定 RNA 纯度并定量.取 500 ng 的总RNA 进行反转录,合成 cDNA,操作步骤按照 TaKaRa公司反转录说明书进行.
1. 5 实时定量 PCR 检测 NLRP3 表达
利用安捷伦 Mx3000PTMReal-time PCR 系统进行扩增,操作步骤按照 TaKaRa 公司 SYBR Green I 试剂盒进行操作.以实验组和对照组的 cDNA 为模版,扩增引物为 NLRP3F: 5'-GAG TTC TTC GCT GCT ATG T-3'; NLRP3R: 5'- ACC TTC ACG TCT CGG TTC-3';ActinF: 5'-TCA CCA ACT GGG ACG ACA-3'; ActinR:5'-ACA GCA CCG CCT GGA TAG-3'.实验重复 3 次,每次进行 3 复孔检测.
1. 6 Western blot 检测 NLRP3 表达
实验组和对照组心肌成纤维细胞中加入 100 μl含有蛋白酶抑制剂的 RIPA 裂解液,冰上孵育裂解细胞,低温下 13 000 × g 离心 15 min.取上清进行蛋白定量.经 10% SDS-PAGE 凝胶分离,恒压转移至PVDF 膜上.将 PVD 下膜用 anti-NLRP3 抗体( 1 ∶ 500稀释) 进行在4 ℃条件孵育过夜.再用辣根过氧化物酶标记的羊抗兔( 1∶ 5 000 稀释) 二抗常温孵育 2 h.ECL 发光显影.将膜 stripping 后,重新封闭,加入内参β-actin 抗体( 1∶ 6 000,北京中杉金桥生物技术有限公司) 作为对照[4].本实验重复 2 次.
2 结 果
2. 1 NLRP3 基因表达水平
经过 Real-time PCR 检测发现,在氯化钴和低氧培养的实验组中 NLRP3 基因表达明显高于对照组.见图1.
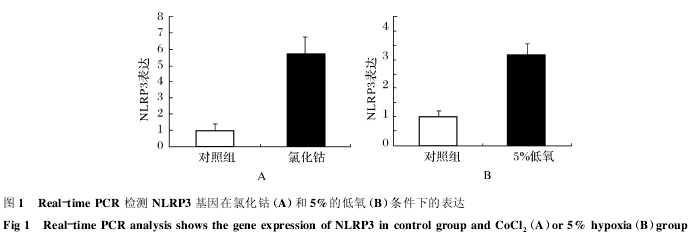
2. 2 NLRP3 蛋白质表达水平
Western blot 实验检测在氯化钴和低氧培养的实验组中,NLRP3 蛋白质表达明显高于对照组.见图 2.
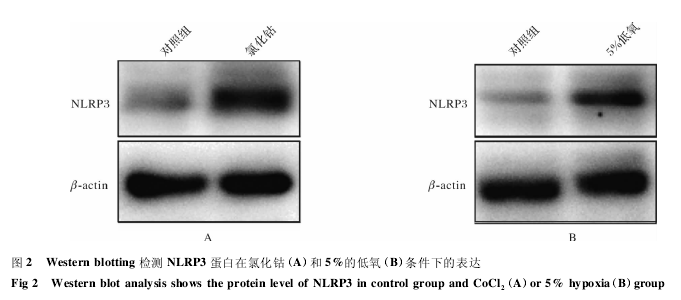
3 讨 论
NLRP3 基因定位于 1 号染色体长臂上,是由 pyrin样蛋白所编码,包括 pyrin 样结构域、核苷酸结合结构域及亮氨酸富含重复基序.它能与含有 pyrin 结构域的凋亡相关斑点样蛋白 CARD 结合[5],CARD 蛋白与炎症和免疫反应相关.NLRP3 蛋白可能是 NF-κB 信号通路的活化因子[6].
NLRP3 炎症小体是多蛋白复合体,NLRP3 能够通过活化细胞因子白介素前体引起促炎因子过度表达,导致慢性炎症和自身免疫疾病.NLRP3 能够被很多刺激因素激活,包括细菌、病毒、真菌、死细胞复合物及晶体颗粒等.炎症小体的活化对于病源清除和免疫应答诱导起着重要作用[7],而 NLRP3 炎症小体活性失调能够引起多种疾病的发生,包括冷吡啉相关周期性综合征、痛风、Ⅱ型糖尿病、克罗恩病、动脉粥样硬化等[8].NLRP3 炎性体促进炎症的有害作用和活性失调引起疾病的发生将是我们研究的重点.
在缺血状态下,心肌细胞氧含量迅速下降,可引起心肌缺血,局部组织细胞发生死亡.本研究利用氯化钴和低氧细胞培养箱体外培养大鼠的心肌成纤维细胞,模拟心肌缺氧微环境,利用实时定量 PCR 和Western blot 实验检测,结果发现 NLRP3 基因在实验组中的表达明显高于对照组.实验结果提示,在心肌缺氧状态下,NLRP3 可能作为重要的信号分子参与了心肌损伤的过程.
综上所述,当心肌细胞发生缺氧时,NLRP3 表达增高,引起一系列的免疫应答反应,导致心肌细胞的进一步严重损伤.通过本课题研究,我们初步认为,NLRP3 可能成为早期诊断心肌缺血缺氧的重要分子靶点,也为心肌缺血后的免疫应答机制提供了一定的分子理论基础.
[参考文献]
[1]SHANTSILA E,TAPP L D,WRIGLEY B J,et al. Receptors tointerleukin-6 and adhesion molecules on circulating monocytesubsets in acute myocardial infarction[J]. Thromb Haemost,2013,110( 2) : [Epub ahead of print].
[2]FRANGOGIANNIS N G,SMITH C W,ENTMAN M L. The in-flammatory response in myocardial infarction[J]. CardiovascRes,2002,53( 1) : 31-47.
[3]SATOH T,KAMBE N,MATSUE H. NLRP3 activation inducesASC-dependent programmed necrotic cell death,which leads toneutrophilic inflammation[J]. Cell Death Dis,2013,4: e644[Epub ahead of print].
[4]张红艳,李彦姝,姚远,等. pGEX-5X-1-hLMO4 原核质粒构建及重组蛋白表达[J]. 东南大学学报: 医学版,2012,31( 2) :139-143.
[5]SAGULENKO V,THYGESEN S J,SESTER D P,et al. AIM2and NLRP3 inflammasomes activate both apoptotic and pyrop-totic death pathways via ASC[J]. Cell Death Differ,2013,[Epub ahead of print].
[6]UNGERBACK J,BELENKI D,JAWAD UL-HASSAN A,et al.Genetic variation and alterations of genes involved in NFkap-paB / TNFAIP3-and NLRP3-inflammasome signaling affect sus-ceptibility and outcome of colorectal cancer[J]. Carcinogene-sis,2012,33( 11) : 2126-2134.
[7]ICHINOHE T,LEE H K,OGURA Y,et al. Inflammasome re-cognition of influenza virus is essential for adaptive immune re-sponses[J]. J Exp Med,2009,206( 1) : 79-87.
[8]MAO K,CHEN S,CHEN M,et al. Nitric oxide suppresses NL-RP3 inflammasome activation and protects against LPS- in-duced septic shock[J]. Cell Res,2013,23( 2) : 201-212.





