
鸭圆环病毒(Duck circovirus,DuCV)和鹅圆环病毒(Goose circovirus,GoCV)为代表的水禽圆环病毒是近年来新发现的一类动物病毒,属于圆环病毒科圆环病毒属,备受广大研究者的关注[1,2].
研究表明,水禽圆环病毒可侵害水禽免疫系统并抑制其功能,临床上造成被感染动物生长迟缓,并容易引起其他细菌和病毒的继发感染与混合感染,给水禽养殖业造成巨大经济损失[3].自1999年首次发现以来,匈牙利、美国、韩国、中国台湾等多个国家和地区相继出现有关水禽圆环病毒感染的报道[4,5].2005年以来,余旭平等[6]和姜世金等[7]先后在中国大陆首先报道从发病死亡的水禽中检出GoCV和DuCV.施少华等[8]和刘少宁等[9]进一步发现中国大陆各主要养鸭省份鸭群中均有DuCV流行。2010年,本课题组对采自广西部分地区的321份鸭组织样品进行检测,DuCV阳性率达18.07%[10].提示水禽养殖行业必须高度重视水禽圆环病毒的检测、监测和防控。
遗传进化分析发现,DuCV和GoCV尽管序列最为接近,但病毒基因组之间仅有60%的同源性,且在病毒两个主要基因之间的3′-间隔区序列特征方面也存在明显差异[2].另外,目前对DuCV和GoCV的宿主范围尚无研究报道,两种病毒之间是否存在跨种间传播现象亦缺乏充分证据,有待通过对大量的临床样品进行检测加以证实。
由于目前水禽圆环病毒还不能在体外进行培养,临床检测和研究中无法采用病毒分离鉴定等常规方法而只能凭借PCR方法进行检测。多重PCR是在PCR基础上发展起来的,即在同一反应体系中加入多对引物,从而实现对多个目的基因同时进行扩增的方法,具有可同时检测、鉴别多种病原体等突出优点,在临床多种病原混合感染和鉴别诊断上具有独特的优势和很高的实用价值[11,12]
.
本研究设计了两对特异性引物,经过条件筛选和优化,建立了鸭圆环病毒、鹅圆环病毒双重PCR检测方法,为开展流行病学调查、临床样品检测和跨种间传播研究提供新的技术手段。
1 材料与方法
1.1 材料
1.1.1 主要试剂
MiniBEST Viral RNA/DNA Extraction KitVer.4.0、Ex Taq酶、pMD18-T载体、T4 DNA连接酶、限制性内切酶、DL2000 DNA Marker等均购自宝生物工程(大连)有限公司;感受态 DH5α、DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技(北京)有限公司;其它试剂为国产分析纯。
1.1.2 阳性模板、病毒株和临床样品DuCV和GoCV阳性组织样品由本实验室检测、鉴定并保存;H9N2亚型禽流感病毒(AIV)、鸭肝炎病毒Ⅰ型(DHV)由本实验室保存,新城疫活疫苗(La Sota株)、鸭瘟活疫苗(C-KCE株)、鸡传染性贫血病活疫苗和小鹅瘟活疫苗(GD株)均为市售商品化弱毒疫苗。247份临床健康鸭组织样品(包括肝、脾、肺、肾等)和253份临床健康鹅组织样品由本实验室从广西部分市活禽市场采集、保存。
1.2 方法
1.2.1 引物设计和合成
从GenBank中下载鸭圆环病毒和鹅圆环病毒序列,利用DNAStar软件进行多序列比对,在保守区运用Primer premier 5.0设计引物,引物由广州Invitrogen公司合成。引物序列见表1.
1.2.2 病毒核酸提取
被检组织样品充分研磨后,将组织匀浆以无菌PBS(pH=7.4)1∶5稀释,反复冻融3次,8 000 r/min离心10 min,取上清备用。按试剂盒说明书提取病毒基因组。
1.2.3 双重PCR反应条件的优化
对引物、模板等用量进行优化和多次重复试验后确定最佳反应用量。按55~62 ℃依次递增,多次重复试验后确定最佳退火温度。PCR扩增产物用1.5g/L琼脂糖凝胶进行电泳鉴定。
1.2.4 特异性试验
利用优化好的双重PCR反应体系,以DuCV、GoCV、AIV、DHV、新城疫病毒(NDV)、鸭瘟病毒(DEV)、鸡传染性贫血病病毒(CIAV)和小鹅瘟病毒(GPV)的核酸为待检样品进行检测,检验双重PCR方法的特异性。
1.2.5 敏感性试验
用上述引物对分别对DuCV和GoCV阳性样品进行单重 PCR 扩增,回收 PCR 扩增产物分别连接到 pMD18-T 载体构建阳性模板质粒。使用 Biodropsis BD-1000 超微量核酸蛋白分析仪(北京五洲东方科技发展有限公司)测定DuCV和GoCV阳性模板质粒浓度,计算出模板拷贝数,并按10倍递增稀释后进行双重PCR,同时设阴性对照,以评估该方法的灵敏性。
1.2.6 符合性检验
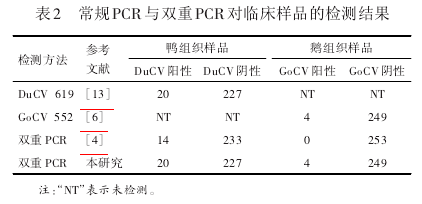
参照文献报道[4,6,7]的常规单重 PCR、双重PCR 和本研究建立的双重 PCR 分别对送检的247份鸭组织样品和253份鹅组织样品进行检测,比较检测结果的一致性,并将扩增产物进行测序验证,评估该方法的实用性。
2 结 果
2.1 双重PCR反应体系的构建和优化结果
通过对各反应条件的优化,最终确定双重PCR反应体系为25 μL:2×Ex Taq Buffer 12.5 μL;引物(20 pmol/μL)各0.5 μL;基因组模板各3 μL;ddH2O补加至25 μL.反应退火温度的优化结果见图1.确定最佳的反应条件:94 ℃ 4 min;94 ℃40s,57℃ 60s,72℃ 60s,35个循环;72℃ 10min.
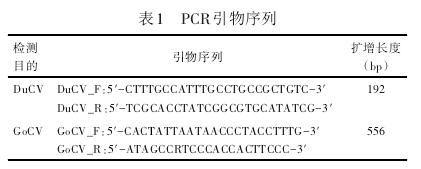
2.2 双重PCR特异性试验结果特异性试验结果显示,DuCV和GoCV阳性模板均能扩增出192 bp和556 bp特异性条带,而其他病原均未扩增出特异条带(见图2)。
2.3 双重PCR敏感性试验结果
回收DuCV、GoCV PCR扩增产物分别连接到pMD18-T载体成功构建了阳性模板质粒。经检测计算,DuCV、GoCV阳性模板质粒中核酸拷贝数分别为1.43×107、2.36×108拷贝/μL.将两个阳性模板质粒分别进行10倍阶梯稀释,采用所建立的双重 PCR 方法分别进行扩增。由图 3 可知,该方法对 DuCV 和 GoCV 的最低检出限分别为104拷贝/μL和105拷贝/μL.
2.4 符合性检验结果
常规单重PCR、双重PCR和本研究建立的双重PCR的检测结果见表2.由表2可知,本研究所建立双重 PCR 方法检测结果与文献[6,13]所提供方法的检测结果完全一致,DuCV 和 GoCV 阳性率分别为 8.01%(20/247)和 1.6%(4/253)。而采用文献[4]方法检测DuCV阳性样品时有6份被判为阴性,检测GoCV时4份阳性样品均被判为阴性。对扩增产物的测序结果也进一步证实双重PCR方法检出的阳性样品均为真实的阳性样品。
同时分别对鸭组织病料进行GoCV、鹅组织病料进行DuCV检测,并未检出相应的病毒,没有发现交叉感染的现象。
3 讨 论
多重PCR技术保留了常规PCR技术特异性和敏感性的同时,具有能同时对多个基因进行扩增或检测的优点,在动物疫病监测中得到广泛应用[12].目前,在DuCV和GoCV的检测和流行病学调查中所采取的基本上都是传统的单重PCR方法,能够同时检测并区分两种病毒的双重PCR方法只有中国台湾的Chen等[4]曾经报道过。而在本研究所进行双重PCR与单重PCR符合性检验发现,Chen 等[4]的方法在检测 DuCV 样品时有6份阳性样品被错判为阴性,在检测GoCV样品时4份阳性样品均被错判为阴性,表明其建立的方法并不适合于当前中国大陆流行毒株的检测;而本研究所建立的双重PCR方法与中国大陆其他研究者建立的单重PCR方法检测结果、测序验证结果完全一致。对中国大陆和台湾地区水禽圆环病毒的核苷酸序列同源性分析表明,DuCV的核苷酸同源性为82.5%~97.2%,GoCV的核苷酸同源性为90.0%~91.2%,表明不同地区流行毒株之间的核苷酸差异是造成Chen等[4]的方法在符合性试验中表现不佳的原因,也凸显出必须根据中国大陆流行毒株序列设计引物才能达到理想的效果。
另外,特异性和敏感性检验结果显示,本研究所建立的双重 PCR 方法对 AIV、DHV、NDV、DEV 和GPV等其他常见水禽病原不发生扩增,并能检出最少 104拷贝/μL 的 DuCV 核酸和 105拷贝/μL 的GoCV核酸,表明该方法具有良好的特异性和敏感性,可以满足临床检测和流行病学调查的需要。
利用本研究所建立的双重PCR方法,对在广西活禽市场采集的247份临床健康鸭组织样品和253份鹅组织样品进行检测,DuCV和GoCV检出率分别为8.1%和1.6%,表明广西临床健康水禽群中有DuCV和GoCV在流行。与DuCV相比,目前中国大陆对GoCV流行病学调查的文献和数据较少,本研究结果丰富了中国大陆GoCV流行病学研究的基础数据。
综上所述,本研究建立的DuCV、GoCV双重PCR检测方法具有良好的特异性和敏感性,为开展水禽圆环病毒的临床检测、流行病学调查乃至跨种间传播研究提供有力的技术手段。





