
登革病毒(dengue virus,DENV)是一种通过媒介昆虫传播的单股正链RNA病毒,属于黄病毒科黄病毒属。DENV有4种血清型:DENV-l、DENV-2、DENV-3和DENV-4,可引起登革热(dengue fever,DF)和登革出血热(dengue haemorrhagic fever,DHF)两种不同类型的急性传染病。DF主要流行于热带及亚热带地区,每年能引起5亿~10亿人口发病,DHF是DF的一种严重症状,每25万~50万例DHF中有2.4万例患者死亡。目前为止,尚无一种登革疫苗被批准应用。DENV的基因组为单股正链RNA,全长约11kb,由3个结构基因(C、prM、E)和7个非结构基因(NS1,NS2A,NS2B,NS3,NS4A,NS4B和NS5)组成。
prM蛋白在病毒成熟时经酶裂解形成膜蛋白M后固定于病毒包膜内层。E蛋白是病毒包膜的主要糖蛋白,与病毒的细胞嗜性、红细胞凝集以及诱导红细胞凝集抑制抗体和中和抗体的产生等有关。prM和E蛋白共表达可形成病毒样颗粒(virus like particle,VLP),而后者是目前研制登革疫苗的重要方向之一。
本研究建立了表达DENV-2 prM/E蛋白的Bac-to-Bac杆状病毒表达系统,为进一步研制登革疫苗奠定了基础。
1、 材料与方法
1.1 材料
含DENV-2 prM/E基因的质粒为首都医科大学安静教授馈赠。Sf9昆虫细胞、pFastBac Dual质粒、MAX Efficiency DH10Bac competent cells均购自Invitrogen公司。pGEM-T Easy为Promega产品。限制性内切酶XhoⅠ和NheⅠ购自NEB公司。小鼠抗prM/E单克隆抗体购自Abcam公司,FITC标记的山羊抗小鼠IgG购自中杉金桥公司。
1.2 方法
1.2.1 prM/E基因的克隆。本研究以含DENV-2 prM/E基因的质粒为模板,扩增prM/E基因。扩增片段大小为2007 bp,引物由北京博迈德生物科技公司合成。扩增条件温度为95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸150 s,30个循环;72 ℃总延伸10 min。通过琼脂糖凝胶电泳鉴定并切胶回收目的基因。将获得的prM/E基因克隆到pGEM-T Easy载体(pGEMT-prM/E),并进行DNA序列测定,聚合酶链反应(polymerase chainreaction,PCR)引物序列见表1。
【表1】
1.2.2 重组杆状病毒转移载体的构建。用限制性内切酶XhoⅠ和NheⅠ双酶切质粒pGEMT-prM/E,电泳回收prM/E基因,将其与用相同酶双酶切的pFastBac Dual质粒连接。连接产物转化感受态大肠杆菌DH5α,挑选阳性克隆,用双酶切和测序的方法鉴定构建的转移载体(pFBD-prM/E)。
1.2.3 重组杆状病毒穿梭载体的构建。将转移载体转化同时含有杆状病毒穿梭载体Bacmid和Helper质粒的感受态DH10 Bac,在Helper质粒表达的转座蛋白的作用下pFBD-prM/E和Bacmid发生转座。在含50 μg/ml卡那霉素、7 μg/ml庆大霉素、10 μg/ml四环素的LB培养基中筛选DH10Bac转化子,通过蓝白斑筛选,挑选白色菌落,培养并提取重组Bacmid(rBacmid-prM/E)。空pFastBac Dual质粒(rBacmid-NC)经同样转化和筛选步骤,作为阴性对照。
1.2.4 重组杆状病毒的制备及其滴度测定。使用含10%胎牛血清(fetal bovine serum,FBS)的Supplemented Grace’s Insect培养基培养Sf9细胞到对数生长期,细胞存活率>95%。通过阳离子脂质体CellfectinⅡ,将rBacmid-prM/E转染Sf9细胞。用rBacmid-NC和仅含脂质体的培养基分别转染Sf9细胞,作为对照。
对经27 ℃培养转染后的细胞每日观察其病变,待细胞出现病毒感染晚期迹象后收集含有病毒的培养上清,即第一代(P1)病毒,分别命名为P1-prM/E和P1-NC。将P1代病毒按MOI=0.1感染2×106细胞/孔(培养于六孔细胞板)的Sf9细胞,待4 d后出现明显细胞病变时收集培养上清,即获得P2代病毒。按此方法获得P3代病毒。
1.2.5 间接免疫荧光法检测目的蛋白的表达。用P3-prM/E感染Sf9细胞,以P3-NC感染相同细胞作为对照。培养72h后弃培养液,采用4℃低温预冷的甲醇固定细胞,以小鼠抗prM/E单克隆抗体为一抗,FITC标记的山羊抗小鼠IgG为二抗,作间接免疫荧光测定检测目的蛋白表达,在荧光显微镜下观察结果。
2、 结果
2.1 prM/E基因的获得和转移载体的构建
经过PCR扩增得到基因片段大小约为2007bp的两侧增加了酶切位点的prM/E基因(如图1所示)。

将PCR产物克隆至pGEM-T Easy载体,获得重组质粒。经DNA测序鉴定证实插入序列正确。进而构建含有prM/E基因的重组转移载体(如图2所示)。

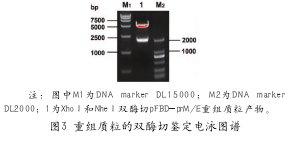
将该质粒用XhoⅠ和NheⅠ双酶切后电泳回收目的片段,连接到pFastBac Dual质粒上,得到重组转移载体pFBD-prM/E。后者经同样的双酶切,得到5224 bp和2007 bp的两条基因片段,其大小与预期相符,表明成功构建了转移载体(如图3所示)。
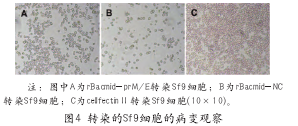
2.2 rBacmid-prM/E转染Sf9细胞引发细胞病变
穿梭质粒rBacmid-prM/E和rBacmid-NC转染Sf9细胞3 d后倒置显微镜下观察细胞,与仅加入脂质体的Sf9细胞相比可见转染后细胞变圆、变亮;转染后6 d可见细胞出现破碎、脱落等明显的病变样改变,表明有重组病毒产生(如图4所示)。
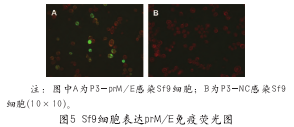
2.3 prM/E蛋白表达的间接免疫荧光分析
间接免疫荧光检测结果显示,用第3代重组病毒P3-prM/E感染的Sf9细胞可见特异性绿色荧光,而用对照重组病毒P3-NC感染的细胞未见特异性荧光,表明前者表达了prM/E蛋白(如图5所示)。
3、 讨论
目前,尽管与DENV同属于黄病毒科的日本脑炎病毒和蜱传脑炎病毒等已有理想的疫苗用于临床,但至今尚无登革疫苗被批准使用。近年,由Sanofi Pasteur疫苗研究所研发的以黄热病毒疫苗17D为骨架的DENV四价嵌合疫苗在临床试验中显示了很好的免疫性及安全性,但其中DENV-2型的免疫效果甚微。VLP作为一种新型疫苗由于接近天然病毒的形态而容易被机体免疫系统所识别,同时具备不会发生病毒毒力回复、安全可靠等优点,成为研制登革疫苗的重要方向。
研究表明,prM与E蛋白的相互作用决定着病毒颗粒的稳定性并且是VLP形成与大量分泌的重要条件,黄病毒科病毒的prM蛋白和E蛋白共表达时可组装形成VLP。因此,许多疫苗方面的研究无论是VLP、嵌合减毒活疫苗还是DNA疫苗,均利用prM/E组合的形式,这些候选疫苗可在动物体内产生中和抗体并保护其免受致死剂量病毒的攻击。
目前,用于共表达prM蛋白和E蛋白的系统很多。大肠杆菌等原核表达系统由于缺乏蛋白翻译后的糖基化等修饰加工环节,表达产物的生物活性较低,影响其在疫苗制备方面的应用。酵母表达系统表达外源蛋白水平高,并能进行糖基化修饰,但其糖基化修饰具有局限性,且表达前需要进行密码子优化。而杆状病毒系统作为一种真核表达系统具有存在于高等真核细胞的多种蛋白质的修饰、加工和转运体系,表达的蛋白接近天然构象,更易于形成VLP;并且杆状病毒在自然条件下不能感染脊椎动物,生物安全性好,因而越来越多地应用于疫苗的研制。
本研究所选用的Bac-to-Bac杆状病毒表达载体是由Luckow等开发的一种快速、高效产生重组苜蓿丫蚊夜蛾核型多角体病毒的技术,克服了传统昆虫杆状病毒重组效率低、耗时长和不易筛选等缺点。本研究成功构建了表达DENV-2 prM/E蛋白的Bac-to-Bac杆状病毒表达载体,为今后DENV prM/E蛋白的功能研究、DENV感染的诊断及DENV VLP疫苗的研制奠定了基础。





